 |
El experimento, relatado en forma simple, fue corno sigue: se cultivaron in vitro células de la glándula mamaria – la ubre – de una oveja adulta de raza Finn Dorset que se encontraba en el último trimestre de preñez, Las células fueron posteriormente fusionadas, mediante un shock eléctrico, con ovocitos (óvulos inmaduros) a los que previamente se les había extraído el núcleo (ovocitos anucleados), provenientes de una oveja de raza Scottish Blackface (blanca con cara negra). Estos ovocitos, fertilizados de manera artificial, luego de ser activados con una suave descarga eléctrica, comenzaron a dividirse. Cuando los embriones llegaron a poseer entre ocho y dieciséis células (estadio de mórula), se implantaron en el útero de otras ovejas Scottish Blackface. Transcurridos 148 días nació un cordero de 6,6kg de peso, totalmente blanco, el primer vertebrado obtenido a partir de una célula tomada de un mamífero adulto. Estudios moleculares demostraron que la dotación genética del cordero clonado era similar a la de la oveja de la cual se extrajeron las células de la glándula mamaria, y diferente a la de la oveja utilizada como portadora.
Desde el siglo pasado se sabe que es posible clonar plantas a partir de una única célula tomada de alguna de sus partes (tallo, hoja, raíz, etc.). Sin embargo, salvar la distancia entre la clonación de plantas y la de animales iba a llevar su tiempo. No fue hasta 1967 que John Gurdon, destruyó con radiación ultravioleta el núcleo de huevos no fecundados de una especie de rana africana, Xenopus laevis, e inyectó en ellos núcleos de células intestinales (células ya diferenciadas) de la misma especie de rana. Logró de este modo desarrollar embriones, los cuales, sin embargo, morían sin superar el estadio de renacuajos. Los resultados de Gurdon fueron considerados como una indicación de que las células de tejido adulto conservan el genoma completo, pero con alteraciones importantes.
Los primeros métodos de transferencia nuclear en mamíferos fueron desarrollados en ratones y presentaron inesperadas dificultades, aparentemente relacionadas con el ciclo celular, que es de importancia crucial en la determinación de la compatibilidad entre el núcleo donante y el ovocito receptor.
En lo que se refiere a ovejas y vacas, dos trabajos fueron particularmente relevantes. Durante la década de los ochenta, S. Willadsen, del Institute of Animal Physiology, en Cambridge, logró la producción de clones ovinos adultos fusionando células de un embrión temprano (que contenía de ocho a dieciséis células) con aproximadamente la mitad del citoplasma de un ovocito no fertilizado. Por su parte, N. First, de Madison University, en Wisconsin, tomando una célula de un embrión bovino de seis días de gestación, consiguió su fusión con el citoplasma de un ovocito anucleado, por medio de una descarga eléctrica. Obtuvo así clones viables de bovinos.
En marzo del año pasado, K. Campbell, I. Wilmut y sus colegas del Roslin Institute introdujeron una novedad respecto de las experiencias anteriores. Tomaron las células de un embrión ovino de nueve días y, en lugar de fusionarlas inmediatamente con los ovocitos receptores, las cultivaron in vitro para hacerlas proliferar. Las células fueron posteriormente fusionadas con ovocitos anucleados, originando cinco embriones que se implantaron en los úteros de diferentes ovejas. De esta experiencia nacieron tres corderos que murieron en forma prematura y dos que crecieron normalmente.
Davor Solter, de uno de los institutos Max Planck, dedicado a la inmunobiología, al comentar en Nature de marzo 1996 tales resultados, fue explícito: La clonación de mamíferos a partir de células adultas resultará considerablemente más difícil, pero no debe ser considerada imposible; aclaró que el problema crucial que restaba resolver era el de la compatibilidad entre el citoplasma receptor y el núcleo donante, todavía poco comprendida. En este punto parece radicar el éxito del reciente trabajo de Wilmut y sus colegas, esto es, en el hallazgo de un método que, una vez efectuado el transplante e iniciado el desarrollo, haga compatibles al núcleo donante – tomado de una célula somática de tejido adulto – con el citoplasma del ovocito receptor. Dicha compatibilidad dependería de la posibilidad de sincronizar las fases en las que se encuentren ambos antes de la fusión.
Recordemos que, durante el ciclo vital de una célula – con sus dos estadios, la interfase y la división –, la duplicación del ADN se lleva a cabo durante el período S (o sintético) de la interfase. El período que precede al S es el G1 (de gap, brecha), y el que le sucede, G2. EI ciclo de división celular sigue, entonces, los siguientes pasos: G1, S, G2, mitosis, y recomienza en G1 (Fig. I). La duración del ciclo es regulada por su detención en un punto específico de G1. En ta1 caso, se dice que la célula se ha retirado del ciclo celular, y que se encuentra en el estado GO. Al reanudar el crecimiento, la célula retoma el período G1, en el cual el contenido de ADN es diploide, es decir, tiene el número normal de cromosomas – dos copias de cada uno – ; en el resto de los períodos, es mayor.
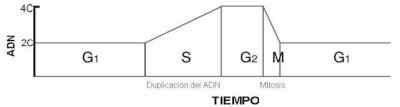 |
FIG 1
CICLO VITAL DE UNA CÉLULA : MUESTRA LOS CAMBIOS EN EL CONTENIDO DE
ADN DURANTE LOS DISTINTOS PERÍODOS, EN FUNCIÓN DELTIEMPO. 2C
CORRESPONDE A UN CONTENIDO DIPLOIDE DE ADN (DOS COPIAS DE CADA CROMOSOMA)
Y 4C A UN CONTENIDO TETRAPLOIDE (CUATRO COPIAS DE CADA CROMOSOMA). LA EXTENSIÓN
DE CADA ETAPA DEL CICLO ES PROPIA DE CADA CÉLULA.
En las experiencias previas realizadas con mamíferos, el núcleo
tomado de un embrión temprano se encontraba, la mayoría de las
veces, en las fases S o G2 (en las que existen más de dos y hasta cuatro
copias de cada cromosoma). En estos casos, al ser implantado el núcleo
en un ovocito detenido en una fase sólo compatible con núcleos
diploides, habría replicaciones adicionales, lo cual impediría
el desarrollo normal del embrión. Wilmut y sus colegas lograron evitar
esta asincronía reduciendo drásticamente la concentración
de nutrientes del medio en el cual se hallaban en cultivo las células
que aportarían sus núcleos, Io que inactiva sus ciclos de crecimiento
y las detiene en la fase GO (Fig. 2). Así se logró una mejor
sincronía en los tiempos de replicación, una vez transplantados
los núcleos e iniciado el desarrollo del embrión.
 |
FIG 2
ESQUEMA EXPERIMENTAL QUE PERMITIÓ LA CLONACIÓN DE UN MAMÍFERO
A PARTIR DE UNA CÉLULA ADULTA.
El trabajo que hemos comentado no sólo representa una importante corroboración
de la hipótesis de que el material genético de las células
adultas no sufre alteraciones irreversibles durante su desarrollo y diferenciación;
también aporta una promisoria técnica de experimentación.
En cuanto a las potenciales aplicaciones, la más obvia consiste en
la posibilidad de clonar ovejas seleccionadas por sus rasgos preferenciales.
Sin embargo, para poner en práctica lo último en gran escala,
se deben aún efectuar substanciales mejoras a las técnicas aplicadas.
La célebre oveja obtenida de la célula mamaria, bautizada Dolly,
representa apenas un 3,4% de efectividad respecto del número total
de núcleos transferidos.
Dos sucesos anecdóticos pueden dar una idea del impacto social de estos resultados. El primero se relaciona con el hecho de que dos de los cinco autores que firman el trabajo pertenecen a PPL Therapeutics, compañía que se dedica a la biotecnología e investiga acerca de la crianza de animales con el propósito de fabricar productos medicinales. Al día siguiente de la publicación en un periódico del adelanto de los resultados que aparecerían en Nature, el valor de las acciones del PPL Therapeutics subió de 0,25 a 3,60 libras. El segundo hecho es de orden político: en el editorial del número de Nature mencionado, los editores hicieron saber que un académico de Harvard, al enterarse de que se publicaría el artículo de Wilmut y sus colegas, pidió que se lo retirara de la revista argumentando que: En la medida en que el procedimiento se convierta en algo cada vez más común, su abuso por parte de grupos extralegales o extranjeros es casi inevitable. Si bien publicaron el trabajo, los editores de Nature reconocieron que, más allá de los obstáculos experimentales que aún existen, la clonación de las mamíferos aparece en el horizonte de las posibilidades científicas, y que, como consecuencia, el académico de Harvard estaba en lo cierto cuando señaló que, hasta ese momento, la discusión del tema había sido inadecuada.
¿Cómo fue el proceso de clonación de la oveja Dolly?
De la ubre de la madre de Dolly (la llamada original en el dibujo), los científicos sacaron una célula, que contiene todo el material genético (ADN) de la oveja adulta.
Después, la otra oveja, a la que llamaremos oveja X, le extrajeron
un óvulo, el cual serviría de célula receptora. Al óvulo
se le sacó el núcleo, eliminando así el material genético
de la oveja donante.
Se extrajo el núcleo de la célula mamaria y, mediante impulsos
eléctricos, se fusionó al óvulo sin núcleo de
la oveja donante. Con los mismos impulsos se activó al óvulo
para que comenzara su división, tal y como lo hacen los óvulos
fertilizados en un proceso natural de reproducción.
Al sexto día, ya se habrá formado un embrión, el cual fue implantado en el útero de una tercera oveja, la madre sustituta, que tras un periodo normal de gestación, dio a luz a Dolly: una oveja exactamente igual a su madre genética.
Clonación animal sí, clonación animal no:
Las alteraciones del patrimonio genético en animales plantean problemas éticos. Entre las consecuencias que se han barajado para considerar ilícita la clonación es el factor medioambiental. A la larga supondría un detrimento de la variabilidad genética y de adaptación de las especies. Debemos evitar el abuso de la naturaleza, protegerla de los efectos de una manipulación irracional e injustificada por parte del hombre.
Algunos investigadores consideran que el uso y manipulación del genoma de animales y vegetales puede ser uno de los principales instrumentos para acabar con el hambre del mundo o aportar excelentes fábricas vivas de sustancias químicas muy valiosas para el hombre.
Como principio ético debemos decir que estas alteraciones deben estar orientadas al servicio del hombre o la naturaleza de forma directa o indirecta, y como consecuencia el investigador no puede actuar con la intención de dañar con la manipulación del genoma, ni al propio animal ni a los seres humanos.
Con la finalidad de evitar que esto suceda, el Grupo de Asesores sobre las Implicaciones Eticas de la Biotecnología de la Comisión Europea (GAIEB) dictaminó en Mayo de 1997, a petición de la Comisión Europea, lo siguiente:
La clonación de animales de cría o de animales de laboratorio sólo es éticamente aceptable si se lleva a cabo con estricta consideración del bienestar de los animales, bajo la supervisión de organismos de control.
Los requisitos éticos necesarios son:
Evitar o minimizar el sufrimiento de los animales.
Sustituir en lo posible la utilización de animales en investigación por otras opciones.
Debe prestarse atención a la necesidad de preservar la diversidad genética de las cabañas de animales.
En lo referente a los humanos:
Debería prohibirse cualquier intento de producir un individuo humano genéticamente idéntico mediante sustitución nuclear a partir de células de un niño o adulto (clonación reproductiva)
Se descarta cualquier intento de crear embriones genéticamente idénticos en ensayos clínicos en técnicas de reproducción asistida, ya sea mediante la división del embrión, ya mediante transferencia nuclear a partir de un embrión existente.
La clonación múltiple es inaceptable.
La investigación sobre sustitución nuclear debería tener como objetivo arrojar luz sobre la causa de una enfermedad humana o contribuir a aliviar un sufrimiento.
La Comunidad Europea debería expresar con claridad su condena de clonación
reproductiva humana.
La finalidad diagnóstica o farmacológica con intención
de luchar contra la enfermedad justifica la aplicación de la ingeniería
genética y en concreto la clonación sobre animales. El respeto
del ecosistema y la biodiversidad representa el horizonte ético que
debe guiar estas acciones de intervención genética, no abusando
de la naturaleza, sino desentrañándola sin destruir sus riquezas.
Por lo tanto, guardando las debidas precauciones de seguridad y teniendo como fin el beneficio del hombre, las aplicaciones de esta nueva técnica en la agricultura, ganadería y en la farmacología parecen totalmente lícitas.
Pero, ¿quién nos dice que esto va a ser realmente así?
Es posible que alguna mente trastornada o maliciosa se sirva de este sistema
para hacer daño a los animales o a las personas.
La clonación pudiera regresar al extinto Tigre de Tasmania
El último tigre de Tasmania murió en cautiverio en 1936, pero
los biólogos del Museo Australiano están trabajando para regresar
la especie por medio de la clonación.
 |
Mike Archer, Director del Museo Australiano, contempla
un cachorro preservado del tigre de Tasmania.
(Australian Museum)
La Unidad de Biología Evolucionaria en el Museo Australiano en Sidney
anunció el 28 de Mayo pasado que un equipo científico ha replicado
genes individuales del tigre de Tasmania usando un proceso conocido como reacción
en cadena de polimerasa (PCR).
El tigre de Tasmania, o Thylacine, era un gran marsupial carnívoro, también conocido como el 'lobo de Tasmania'. El animal de de color marrón-amarillo arenoso a gris y tenía de 15 a 20 rayas oscuras en el dorso desde los hombros hasta la cola. La hembra tenía una bolsa abierta hacia atrás en la cual ella cargaba hasta cuatro cachorros.
 |
Tiempo atrás, el tigre de Tasmania se encontraba por toda Australia continental, extendiéndose por el norte hasta Papúa Nueva Guinea y, por el sur, hasta Tasmania. En el siglo 20 solamente fue visto en Tasmania, pero no ha habido ningún contacto visual documentado por más de 50 años.
En 1999, se extrajo ADN de una muestra cachorro de tigre de Tasmania, preservada en etanol. Se extrajo ADN adicional de dos otros cachorros individuales en 2001. En estas otras fuentes de tejidos se incluyó huesos, dientes, médula espinal y músculo seco.
 |
El tigre de Tasmania
Estas reacciones en cadena de polimerasa amplifican millones de copias del
gen que se estudia. Los PCRs demostraron que no estaban dañados fragmentos
cortos del ADN y que realmente era ADN del tigre de Tasmania. Los investigadores
dicen que no hay razón porque estos no funcienen en una célula
viva.
El Profesor Mike Archer, director del Museo Australiano, está encantado con el progreso del proyecto de clonación. "Esta técnica fue un paso extremadamente crítico en la producción de cantidades suficientes del ADN del tigre de Tasmania para así proceder con la investigación y una noticia extremedamente buena para los pasos futuros en la realización de este proyecto."
Ahora los investigadores intentarán hacer copias en gran cantidad de todos los genes del tigre de Tasmania para que puedan usarse en la construcción de cromosomas sintéticos.
 |
 |
 |
La colección de tejidos en el Museo Australiano fue establecido en 1988 y es uno de los mayores en Australia. Actualmente tiene 26,000 tejidos preservados a –80°C en congeladores ultrafríos o en etanol. Además, el museo tiene un pequeño cachorro de Thylacine que fue preservado en alcohol en 1866.