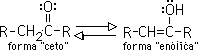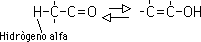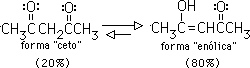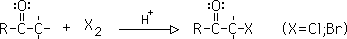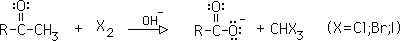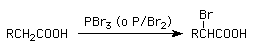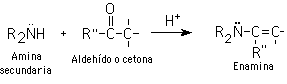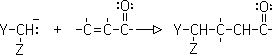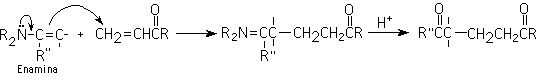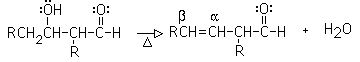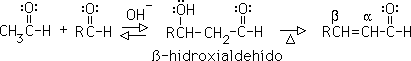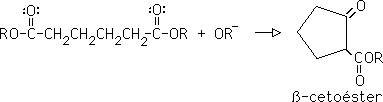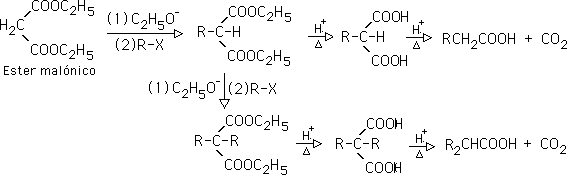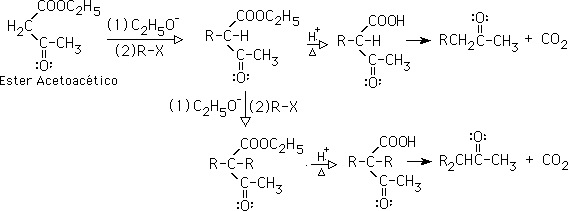ENOLES Y ENOLATOS
Los enoles son compuestos en lo que uno de los átomos de hidrógeno unido a un carbono de un doble enlace es remplazado por un grupo hidroxilo. Los enoles están relacionados con los compuestos carbonílicos por un equilibrio de transferencia protónica conocida como tautomería ceto-enólica:
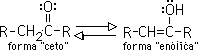
Esta tautomería ceto-enólica es característica de todos los compuestos carbonílicos que contengan hidrógenos alfa (hidrógenos en un carbono adyacente al carbonilo). La forma ceto y la forma enólica no son sino isómeros en equilibrio; el sistema se genera por la migración reversible del hidrógeno alfa al oxígeno del grupo carbonilo:
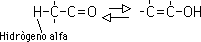
Sólo una pequeña cantidad del enol está presente en un aldehído o una cetona simple, por lo que la forma "ceto" prevalece sobre la forma "enólica". Sin embargo, hay casos en que el equilibrio favorece a la forma enólica. Por ejemplo, en 2,4 pentadiona el isómero enólico compara en estabilidad con la forma ceto y podría predominar en el equilibrio:
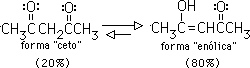
Cuando se remueve el protón del enol o del compuesto carbonílico en equilibrio con éste,se produce un anión deslocalizado conocido como ion enolato:

La formación del enolato de 2,4-pentadiona se favorece porque la carga negativa puede deslocalizarse entre los dos carbonilos:

Los enolatos son las bases conjugadas de compuestos carbonílicos con hidrógenos alfa. Por lo general, el pKa de estos compuestos fluctúa entre 10 y 25, lo que implica que los enolatos son nucleofilos, muchos de ellos fuertes.
Las reacciones que involucran iones enolatos de compuestos carbonílicos son mayormente de adición, condensación o reemplazo. A continuación se ofrece un resumen de algunas de estas reacciones:
1- Halogenación alfa en aldehídos y cetonas:
Puede ser con Cl2, Br2,o I2, y está catalizada por ácido o promovida por base. En ácido, la reacción se limita a una monohalogenación por cada hidrógeno alfa. En medio básico , y en exceso de halógeno, se substituyen todos los posibles hidrógenos alfa.
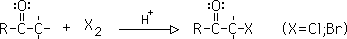
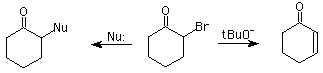
Un aldehído o cetona halogenada en posición alfa puede dar reacción de
substitución nucleofílica o puede dar eliminación (E2), si se usa una base abultada, como t-butóxido (tBuO-):
2- Reacción del haloformo:
En exceso de halógeno, una metilcetona se convierte primero en una sal de ácido carboxílico, liberando un haloformo. Si el halógeno es yodo, se precipita yodoformo, CHI3, un sólido amarillo.
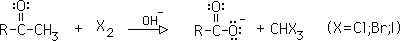
3- Reacción de Hell-Volhard-Zelinski: halogenación alfa en ácidos carboxílicos:
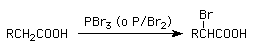
4- Alquilación de enolatos de litio:
Con diisopropilamida de litio (DAL) todos los compuestos carbonílicos se convierten en iones enolato casi en un 100%. Luego de esa conversión el ión enolato se puede usar para reacción con un electrofilo. Si el lectrofilo es un halogenuro de alquilo, se puede llevar a cabo una SN2, generándose una alquilación en posición alfa.

Esta reacción es efectiva en cetonas, ésteres y nitrilos, pero no en aldehídos, que tienden a producir aldoles.
En ciertas instancias, puede haber mezcla de productos, reacciones que pueden estar bajo control cinético o termodinámico:

5- Alquilación de enaminas
Aldehídos y cetonas reaccionan con aminas secundarias para producir enamimas.
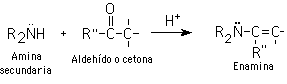
Al igual que los enolatos, las enaminas reaccionan con electrofilos, lo que implica que se puede alquilar un aldehído o una cetona en el carbono alfa por medio de la correspondiente enamina. La hidrólisis de la enamina regenera el aldehído o la cetona original:

6-Adición de Michael (adición conjugada)
Es la adición de un ion enolato (nucleofilo) a un compuesto carbonílico alfa, beta insaturado. Los mejores enolatos para esta reacción son aquellos que están flanqueados por dos grupos que atraigan electrones: enolatos de ß-dicetonas, ß-diésteres, ß-cetoésteres y ß-ceto nitrilos.
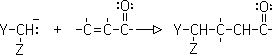
(Y y Z son carbonilos o grupos que halan electrones)
Si en lugar de enolatos se usan enaminas, la reacción se conoce como Stork-enamina
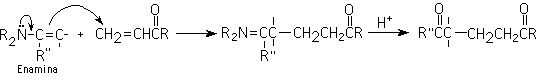
7- Condensación aldólica:
Es la reacción entre dos aldehídos o dos cetonas. Una molécula genera el enolato y ataca la segunda molécula por una adición nucleofílica. El resultado es un ß-hidroxialdehído (aldol= aldehído alcohol)) o una ß-hidroxicetona

Cuando el aldol se deshidrata, se obtiene un compuesto carbonílico alfa, beta insaturado. Esta reacción es la que le dá el nombre de condensación aldólica:
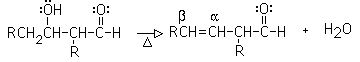
Condensación aldólica cruzada: se produce cuando uno de los dos compuestos carbonílicos carece de hidrógenos alfa. Este es el que sufre la adición del enolato, generado por el otro compuesto carbonílico, que sí tiene hidrógenos alfa. Ambos compuestos carbonílicos pueden ser aldehídos, o cetonas on una mezcla.
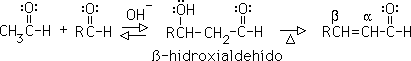
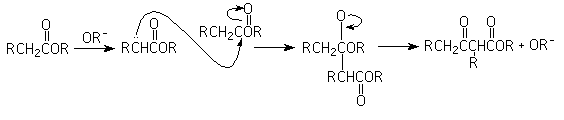
8-Condensación de Claisen
Reacción entre dos ésteres en la que el producto es un ß-cetoéster.

El enolato de un éster ataca al carbonilo del otro, pero en lugar de una adición nucleofílica, se genera una substitución nucleofílica del acilo:
8- Condensación de Dieckmann:
Es una condensación de Claisen intramolecular, pra producir un ß-cetoéster cíclico de 5 o 6 miembros en el anillo:
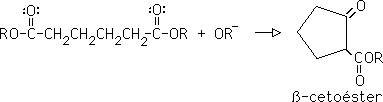
9- Síntesis Malónica: es la formación de ácidos carboxílicos partiendo del éster malónico. La reacción puede ser una monoalquilación o una dialquilación en el carbono alfa del éster, via una SN2.
Una vez alquilado, el producto se hidroliza en medio ácido, lo que genera un ß-diacido, que se descarboxila, generando un ácido carboxílico:
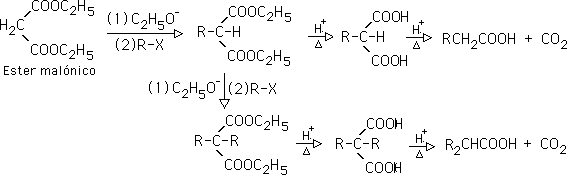
10-Síntesis acetoacética: es la formación de cetonas partiendo del éster acetoacetíico. La reacción puede ser una monoalquilación o una dialquilación en el carbono alfa del éster, via una SN2. Una vez alquilado, el producto se hidroliza en medio ácido, lo que genera un ß-cetoéster, que se descarboxila, generando una cetona:
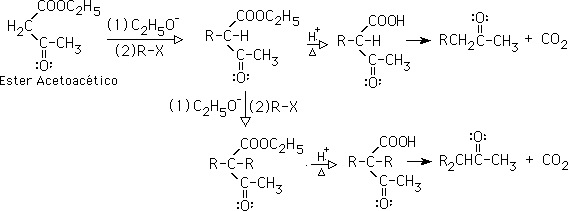
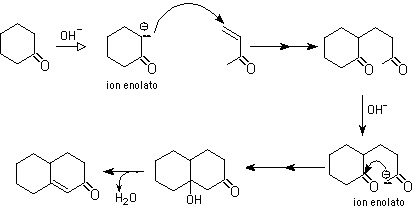
11- Anilación de Robinson:
Es una reacción que combina dos procesos de formación de nuevos enlaces carbono-carbono: reacción de Michael y la adición aldólica. El resultado final es la formaci&oacutre;n de una ciclohexanona.

La primera etapa es la reacción de Michael. La segunda etapa es una adición aldólica intramolecular, responsable de la formación del anillo: