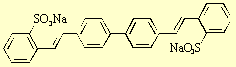Les azutants optiques
a. « Le blanc et le fluorescent
»
Le blanc est par définition
la couleur achromatique lumineuse par opposition au noir qui est la couleur
achromatique sombre. D'un point de vue physique, le blanc idéal
est par convention celui obtenu avec le sulfate de baryum ou l'oxyde de
magnésium qui ont une réflexion de 100 %. Par expérience,
si on a le choix entre deux blancs d'égale luminosité, celui
qui présente une couleur un peu jaunâtre apparaît toujours
moins blanc que celui qui a une couleur bleu-violette. La raison est purement
subjective. En fait, le bleu et le blanc sont des couleurs « froides
» alors que le jaune est une couleur « chaude ». Le jaune
est donc antagoniste du blanc. Un sondage réalisé auprès
de près de 2000 personnes a montré qu'un blanc fluorescent
était considéré par la majorité des personnes
interrogées (95 %) comme plus blanc qu'un neutre car le stimulus
généré par la fluorescence est sans doute plus grand.
Aussi le blanc fluorescent est préféré par une grande
majorité des sondés (82 %).
b. La découverte des azurants
optiques
Depuis toujours, l'homme a recherché
à augmenter la brillance des objets qu'il utilise, et plus particulièrement
les vêtements. Il a donc toujours recherché des procédés
de blanchiment. Depuis la découverte de Krais (Krais
1929) en 1929 démontrant qu'une substance naturelle «
l'esculine » pouvait être fixée sur des vêtements
pour augmenter leur blancheur, de nombreux progrès dans l'industrie
des azurants optiques ont été réalisés.

Figure I-5 :
Structure de l'esculine.
En effet, les limites de l'efficacité
de l'esculine sont très vite apparues en raison de sa fragilité
à la lumière. La synthèse de substances plus efficaces
a alors été explorée. Il a fallu pourtant attendre
1940 pour que des azurants optiques efficaces soient découverts
tels les dérivés de l'acide 4,4'-diamino stilbène-2,2
disulfonique qui constituent aujourd'hui encore la famille la plus importante
d'azurants optiques utilisés industriellement.
c. Nomenclature
Cette nouvelle classe de composés
a été appelée « optical (ou fluorescent) bleaching
agents » en anglais pour ne pas les confondre avec les « chemical
bleaching agents ». Ces deux appellations ont été introduites
pour bien distinguer les réactifs qui peuvent apporter un surcroît
de blancheur et ceux qui éliminent les molécules colorées.
Aujourd'hui, ces composés sont plus connus sous le nom de «
Fluorescent Whitening Agents » (FWAs). En français, on les
appelle « agents d'azurage optique » ou « azurants optiques
».
a. Les azurants optiques peuvent
être classés selon six structures différentes
La liste qui suit présente
la structure des principaux dérivés utilisés dans
l'industrie.
-
(Ai) les dérivés
du stilbène substitués par des groupes aromatiques (ou distyrylbiphényle)
tel que le Tinopal SK,
-
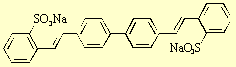
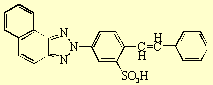
-
ou hétéroaromatiques
(hétérocycliques),
-
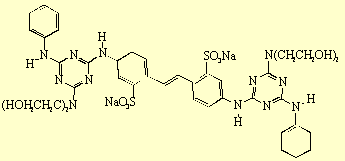
-
(Aii) les acides 4,4'-diaminostilbène-2,2'disulfoniques
acylés par des dérivés de l'acide cyanurique,
-
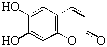
-
(B) les composés
de type coumarine ou carbostyryle,
-
-
(C) les 1,3-diphényl-2-pyrazolines,
-
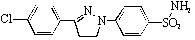
-
(D) les naphtalimides,
-
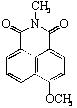
-
(E) les dérivés
du benzoxazole substitué,
-
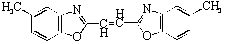
-
(F) les composés
comportant des groupes héteroaromatique, éthylénique
ou aromatique.
-
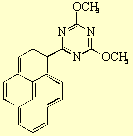
b. Principales utilisations des
azurants optiques
En fonction du type de substrat,
les industriels utilisent différents azurants optiques.Tableau
I-2 : Principales utilisations des azurants optiques (Anliker
and Müller 1975).

c. Les azurants optiques utilisés
en papeterie
Les principaux azurants optiques
utilisés dans l'industrie du papier sont les acides 4,4'-diaminostilbène-2,2'disulfoniques
acylés par des dérivés de l'acide cyanurique ainsi
que les dérivés du stilbène substitués par
des groupements aromatiques que nous noterons respectivement diaminostilbène
et distyrylbiphényle. La Figure I-6 présente les principaux
dérivés de l'acide 4,4'-diaminostilbène-2,2'disulfonique
utilisés en papeterie.

Figure I-6 : Les principaux
dérivés de l'acide 4,4'-diaminostilbène-2,2'disulfonique
utilisés en papeterie.
Ce sont les dérivés
de s-triazinyle (dérivés de la s-triazine substituée)
qui prédominent, dont les substituants R1, R2,
R3 et R4 laissent une certaine marge de manoeuvre
pour des variations chimiques.
Leur solubilité dans
l'eau est assurée par incorporation de groupes sulfonés (-SO3H).
A ce titre, les azurants optiques pour papier sont comparables aux colorants
directs. Le nombre de groupes sulfonés présents dans la molécule
d'azurant constitue un critère général de classification,
et l'on peut ainsi distinguer les différents types suivants :
-
Type disulfoné
-
La molécule de base de
l'acide comporte déjà deux groupes sulfonés. Les substituants
peuvent avoir des propriétés hydrophiles, mais la molécule
ne possède pas de groupes sulfonés supplémentaires.
-
Type tétrasulfoné
-
Outre les deux groupes de la molécule
de base, deux autres substituants sont des groupes sulfonés.
-
Type hexasulfoné
-
Outre les deux groupes de la molécule
de base, quatre substituants sont des groupes sulfonés.
L'affinité des azurants
optiques pour la cellulose dépend principalement du nombre de groupements
sulfonés qu'ils comportent. Le choix entre ces différents
composés est essentiellement défini par le stade d'introduction
de l'azurant optique (size press, couchage). Les papetiers choisiront alors
un type d'azurant optique plutôt qu'un autre.
d. Affinité pour les fibres
cellulosiques
Comme tous les azurants optiques
possèdent des groupes sulfonés pour assurer leur solubilité,
ces dérivés présentent un caractère anionique.
En milieu aqueux, les fibres cellulosiques possèdent également
une surface chargée plus ou moins négativement qui dépend,
entre autres, de la proportion de groupes anioniques présents dans
la matrice. Lorsque la fibre cellulosique de charge négative entre
en contact avec l'azurant de charge également négative, dans
une solution aqueuse exempte d'électrolyte, il se produit tout d'abord
une répulsion qui augmente au fur et à mesure que les deux
systèmes se rapprochent (Figure I-7). Cette répulsion gène
et peut même empêcher le rapprochement entre la molécule
d'azurant optique et la cellulose préalablement à l'intervention
des forces de Van der Waals ou des liaisons hydrogène. On explique
ainsi la faible affinité des azurants pour la cellulose en eau douce.
Afin de minimiser l'effet de la répulsion électrostatique,
il est nécessaire d'ajouter des électrolytes inorganiques
tels que les ions Ca2+ ou Mg2+.

Figure I-7 : Répulsion
et attraction des azurants optiques à la surface de la fibre de
cellulose.
Il est clair que si le nombre
de groupes sulfonés dans la molécule d'azurant est important,
la solubilité va augmenter et l'affinité pour les fibres
de cellulose diminuer. Aussi les azurants de type disulfonique, bien que
moins solubles, ont suffisamment d'affinité pour être appliqués
en eau douce.
d. Limitation
La quantité d'agent d'azurage
optique ne peut pas être augmentée à l'infini. En effet,
la courbe représentant la fluorescence en fonction de la quantité
d'azurant optique atteint un maximum au delà duquel la fluorescence
n'augmente plus. Cette limite correspond à la formation d'agrégats
de molécules d'azurants lorsque tous les sites à la surface
de la fibre sont occupés. De plus, les molécules d'azurants
peuvent absorber la lumière incidente en particulier dans le domaine
bleu violet. Il en résulte un « virage au vert » qui
correspond à un verdissement des fibres visible à l'oeil
nu.
e. Indice de fluorescence(Doshi
1995)
L'indice de fluorescence correspond
à la différence entre la réflexion avec et sans filtre
UV. Cette différence doit correspondre à la participation
de la fluorescence à l'émission de lumière.
Indice Fluorescence = IF =
DB
DB = (brillance sans filtre
UV)-(brillance avec filtre UV).
Ce sont ces indices qui sont
actuellement utilisés pour déterminer la quantité
d'azurant optique présent au sein des papiers.
a. Propriétés physiques
La propriété fondamentale
des substances colorées est de pouvoir absorber la radiation lumineuse
à un endroit précis du spectre UV-visible. Les matières
non colorées telles que les textiles et les papiers, présentent
une forte réflexion car la lumière est dispersée au
niveau de chaque brin des fibres, alors qu'un colorant rouge par exemple
absorbe la majeure partie du bleu, vert et jaune. Sur la Figure I-8 nous
avons schématisé les principaux processus qui peuvent se
dérouler lorsqu'un photon est absorbé.

Figure I-8 :
Mécanismes d'excitation et de désactivation (A : absorption,
F : fluorescence, P : phosphorescence, T : désactivation thermique
et I : interaction).
Lorsqu'un photon est absorbé
par une molécule, son énergie est transférée
à la molécule et est utilisée pour faire passer un
électron de l'état fondamental (S0) jusqu'à
un état excité S1. Ces niveaux d'énergie
sont appelés état singulet. Seul un photon d'énergie
correspondant à la différence d'énergie entre les
états S1 et S0 peut faire passer un électron
d'un état fondamental S0 à un état excité
S1. On peut associer à cette énergie une longueur
d'onde l inversement proportionnelle à cette énergie selon
la loi de Planck :


où h
est la constante de Planck et c
la vitesse de la lumière. La molécule excitée peut
retourner à son état fondamental suivant différents
processus : thermique, désactivation chimique, fluorescence ou phosphorescence.
La désactivation thermique ou chimique se déroule sans émission
lumineuse à l'inverse des deux autres modes de désactivation.
Dans tous les cas, la première étape (10-12 s)
correspond à la perte de l'énergie de vibration par collision
avec les molécules voisines. Il y a ensuite trois possibilités,
soit l'électron retourne directement à l'état fondamental
S0, soit il est transféré dans un état
métastable T1 (état triplet) en empruntant
deux voies différentes pour retourner à l'état fondamental.
La fluorescence correspond à la redescente de l'électron
de l'état singulet S1 à l'état fondamental
S0 dans un temps de 10-9 à 10-8
s sans passer par l'état métastable T1. Il faut
noter toutefois, que l'énergie correspondant à la réémission
d'un photon est plus faible que l'énergie d'excitation car cette
dernière perd de l'énergie par voie thermique (loi de Stokes).
La phosphorescence correspond au passage de l'électron de l'état
triplet T1 vers l'état fondamental S0 soit
directement soit par passage par S1. Le temps pendant lequel
la molécule émet un rayonnement lumineux est dans ce cas
assez long car il dépend du temps de vie de l'état triplet
(de l'ordre de la seconde). Le rendement quantique pour une molécule
donnée correspond au nombre de photons émis par rapport au
nombre de photons absorbés. Un bon azurant optique doit avoir un
rendement quantique le plus proche possible de 1.
b. Isomérie cis-trans
Du fait de la présence
d'une ou de deux doubles liaisons, les azurants optiques peuvent exister
sous forme de plusieurs isomères. Pour les dérivés
de type diaminostilbène il existe les formes cis et trans
et pour les dérivés de type distyrylbiphènyle les
formes cis-cis, cis-trans, trans-trans et trans-cis.
Il faut toutefois remarquer que seules les formes trans fluorescent
(formes (E)-diaminostilbène ou (E, E) distyrylbiphényle).
Nous avons représenté sur la Figure I-9, les équilibres
entre les formes cis et trans et cis-cis, cis-trans
avec entre parenthèses les rendements quantiques correspondants(Werthemann
and Kaschig 1994).

Figure I-9 : Rendements
quantitatifs des réactions de photo-isomérisation des principaux
types d'azurants optiques sur le marché (Rendement quantique).
4. Contribution
des azurants optiques à la blancheur des matériaux(Anliker
and Müller 1975)
Comme nous l'avons mentionné
précédemment, les colorants absorbent et réfléchissent
tout à la fois dans le spectre visible, les azurants optiques absorbent
dans l'ultra-violet et réémettent la lumière dans
la partie bleue à bleu violette du spectre visible. Les azurants
optiques ont donc la faculté de transformer en lumière visible
l'énergie absorbée dans l'UV, et contribuent ainsi à
l'augmentation de la luminosité. La cellulose non blanchie absorbe
une partie de la lumière visible dans le domaine des faibles longueurs
d'onde (400-460 nm). L'absorption dans cette région fait que la
cellulose apparaît plus ou moins jaunâtre. Cette teinte jaune
(déficience en bleu) provenant le plus souvent d'impuretés
(incrustations) absorbant la lumière peut être atténuée
par blanchiment chimique mais n'est pas totalement supprimée. Il
est possible de compenser cette teinte par un léger nuançage
à l'aide d'un colorant bleu, la teinte corrigée est alors
plus blanche à l'oeil mais également moins lumineuse. Les
azurants optiques reflètent par fluorescence un surplus de lumière
dans le spectre bleu à bleu violet. Ainsi, un échantillon
traité avec un azurant optique paraît non seulement plus blanc,
mais également plus lumineux (Figure I-10).

Figure I-10 : Action
des azurants optiques sur le papier.
Lors de l'interaction d'un
azurant optique avec la lumière incidente, les conditions suivantes
doivent être remplies :
-
absorption aussi complète
que possible du rayonnement UV, en particulier entre 350 et 400 nm,
-
réflexion si possible intégrale
de la lumière absorbée, c'est-à-dire rendement quantique
de 1 ou voisin de 1,
-
chevauchement minimum des spectres
d'absorption et de fluorescence, c'est-à-dire faible auto-absorption,
-
pas d'absorption dans le spectre
visible, donc pas de couleur propre.
C. BIBLIOGRAPHIE
Anliker, R. and G.
Müller (1975). Fluorescent Whitening Agents. Stuttgart, Academic
Press.
Ciba-Geigy
(1994). Emploi d'azurants optiques
dans l'industrie papetière.
Dorlars,
A., C.-W. Schellhammer, et al. (1975). "Heterocycles
as Structural Units in New Optical Brighteners." Angewandte Chemie,
International Edition in English 14(10): 665-679.
Doshi,
M. R. (1995). "Optical Properties
of Paper: Color Stripping and Fluorescent Indices." Progress in
Paper Recycling 4(3): 86-89.
Dubreuil,
M. (1994). "How Does the Presence
of Optical Brighteners in Recycled Fibers Affect Paper Optical Properties?"
Progress in Paper Recycling: 96-100.
Dubreuil,
M. (1995). "Introducing to Fluorescent
in Fiber Recycling." Progress in Paper Recycling 101:
98-108.
Krais,
P. (1929). "Uber ein neues Schwarz
und ein neues Weis." Textilberichte 10: 468-469.
Venkataraman,
K. (1971). The Chemistry of Synthetic Dyes. New York, Academic Press.
Werthemann,
D. P. and J. Kaschig (1994). The
envirenmental Fate of Fluorescent Whitening Agents. Appita '94, Appita.
Werthemann,
D. P. and J. Kaschig (1995). "Le
sort environnemental des azurants optiques." La Papeterie(189):
28-33.
Zweidler,
R., J. R. Geigy, et al. (1969). "Einführung
in die Chemie der optischen Aufheller." Textilveredlung 4(2):
75-87.
Zweidler,
R. and H. Hefti (1954). Brighteners,
Fluorescent. Kirk-Othmer Encyclopedia of chemical technology.
T. I. Encyclopedia. New York. 4: 213-226.