Nitrato de Potássio
INTRODUÇÃO:
Esse sem dúvida é um dos químicos mais famigeradamente procurados pelo (piro)químico amador ..
O fato é que essa substância é simplesmente excelente para se ter a mão , não só pelas diversões com pirotecnia (pólvora negra (PN), composições fumígenas/propelente de foguete (KNSU),etc) , mas também como reagente em geral, quando por alguma razão se necessite de um oxidante forte e não tão caro, além de poder ser usado também na fabricação de HNO3 em escala laboratorial, como é descrito em vários sites e livros..
Por essas e várias outras razões, essa página é especialmente dedicada ao legendário nitrato de potássio : tento fazer aqui , utilizando um texto livre e linguagem não muito complicada , uma recompilação crítica de todos os métodos "comuns" e alguns inconvencionais dessa substância, assim como a correlação com alguns fatos curiosos e históricos , suas propriedades e aplicações e como não podia deixar de ser, com a química e ciência em geral.
As vezes eu costumo dar uma passada nos fóruns da web e , pessoalmente falando, morro de rir com relatos de algumas pessoas nesses fóruns e como elas criam confusão quando vão a procura do KNO3 e mesmo atribuem a ele algumas histórias e "lendas" simplesmente absurdas..
Mais risos poderão ser dados quando se chegarem a alguns métodos "alternativos" de preparação dessa substância. rsrsrsr
Uma dessas histórias e que se ouve constantemente é de que o KNO3 é "controlado pelo exército e que necessita de autorização para comprar".. Embora não seja mentira ( pois o KNO3 é realmente 'controlado' pelo exército) , a maioria das pessoas que buscam essa maravilha química simplesmente entram em pânico quando ouvem isso. Eu pessoalmente considero que isso é só um 'status' conferido ao KNO3 com a exata finalidade de realmente manter pessoas "afobadas" longe dele. O KNO3 é um oxidante poderoso, embora bem simples e inferior a muitos outros oxidantes como cloratos , percloratos , permanganatos , dicromatos e outros (e que por tal motivo aparentam ser muito mais "controlados" que o nitrato de potássio); Além disso é imprescindível para muitas aplicações não tão químicas, como poderá ser observado mais adiante; logo, não há como manter ninguém realmente longe dessa substância. Em outras palavras, é um químico tão simples em sua estrutura que mesmo que você não consiga encontrar o KNO3 puro (o que eu acho que é bem difícil se você não encontrar certos fertilizantes), você poderá extrair e purificar esse nitrato de alguns outros fertilizantes ('salitres') ou em ultima instância utilizar os "métodos dos desesperados" que usa basicamente a nitrificação de excretas (merda e urina) de diversos tipos de animais (inclusive humanos) e que embora não sejam dos mais produtivos ainda assim fornecem KNO3...
Em todo caso quem quiser realmente obter nitrato de potássio não terá grandes dificuldades , mesmo que seja usando métodos 'inconvencionais' como este e outros que serão citados , que são de conhecimento de muitas pessoas e que podem ao menos ser encontradas menções ou mesmo referências em livros (especialmente os mais antigos) ou na web .. Hahaha É irônico , mas mesmo que você não queira nitrato de potássio por perto, você não vai conseguir se livrar dele , pois está presente em menor ou maior proporção na terra onde você pisa , em certas plantas e em vários outros locais onde você passa a maior parte da vida e nem desconfia!!!
O nitrato de potássio é um adubo extremamente importante para diversos tipos de plantações , por possuir tanto nitrogênio quanto potássio , indispensáveis.. Outros adubos também possuem, porém nenhum puro que eu conheço tem os dois elementos juntos. O que significa que o cara que esteja cuidando da plantação iria ter que comprar no mínimo dois adubos diferentes para ter o mesmo(?) resultado do que usando só o KNO3, se não houvesse este último..Além disso ele é essencial na hidroponia e muitas vezes encontrado numa excelente pureza em alguns kits hidropônicos (porém muitas vezes não tão baratos). Por isso existem quilos e mais quilos de nitrato de potássio como fertilizante e muitas vezes relativamente barato e em boa pureza. Existem outras aplicações comuns(não tão "químicas"), mas nenhuma que eu conheça tão expressiva no Brasil como a de fertilizante.
Bom, é verdade que as coisas não são assim tão fáceis quanto podem parecer.. Como eu disse antes, apesar de o KNO3 poder ser encontrado com certa facilidade ou mesmo feito apartir de outras fontes , existe um esforço "oculto" de algumas pessoas no sentido deste produto (assim como outros) se tornar o mais raro possível, impuro ou na pior das hipóteses, sumir literalmente das prateleiras.. É por esse motivo que muitas vezes não consegue se comprar pequenas quantidades de KNO3 para experimentos e quando finalmente se encontra um bom fertilizante , ele não vem em pequenas quantidades e isso geralmente não é cômodo(um famoso adubo e que , obviamente, eu não vou citar o nome da marca, por exemplo, vende KNO3 quase puro , mas somente em sacos de 25 Kg). Entretanto mesmo assim algumas pessoas disseram já ter comprado ele "a granel", por quilo (quando havia um saco aberto na loja)..
Antigamente eu quebrava muito a cabeça nessa ilusão de tentar encontrar facilmente pequenas quantidades de KNO3 , que fosse cômoda (que eu não precisasse comprar um saco de 25Kg para fazer experiências, com, digamos, 50 ou 100 gramas..).. Enfim, encontrei um método , originalmente na lista de foguetismo amador "Ad Astra"[6], e que me pareceu o mais adequado. Usava a reação de dupla troca entre o cloreto de potássio (KCl) e o nitrato de sódio (NaNO3) . Ambos encontrados com muito maior facilidade que o nitrato de potássio..Então pesquisando em outras fontes, vi que o método em questão já era bastante conhecido da indústria.. De fato foi o método industrial usado antigamente para produzir nitrato de potássio a partir do nitrato de sódio extraído de Jazidas na América do Sul (especialmente no Chile..Daí o termo "Salitre do Chile" para o nitrato de sódio). Mais detalhes em "Discussão dos resultados e Propriedades". Então decidi parar de ficar me iludindo com toda essa história : tirei a bunda da cadeira e tentei o método e que deu bons resultados.

Clique na figura acima, caso você não saiba do que se trata.
| Substância , Nome "Popular", Fórmula e Estado Físico Em Que é Comumente Encontrada | Peso Molecular Aproximado | Informações Adicionais |
| Nitrato de Potássio ("Salitre"* - KNO3(s)) |
101,1 | Informação de Segurança (Inglês) |
| Nitrato de Sódio ("Salitre do Chile"* - NaNO3(s)) |
85 | Informação de Segurança (Inglês) |
| Cloreto de Sódio ("Sal de Cozinha" - NaCl(s)) |
58,5 | Informação de Segurança (Inglês) |
| Cloreto de Potássio (KCl(s)) |
74,6 | Fertilizante "impuro" ainda fácil de encontrar (O NPK é algo próximo de 00-00-60. Pode ser usado nessa síntese na forma que vem do comércio, isto é, sem nenhuma purificação prévia; contudo você também pode purificá-lo , embora eu não encontre nenhuma vantagem nisso, porque no final tudo é filtrado e recristalizado); Informação de Segurança (Inglês) |
* As pessoas que vão comprar e mesmo alguns produtores de fertilizante costumam confundir esse termo "salitre".. Já vi nitrato de amônio por exemplo rotulado como "salitre". Uns acham que "Salitre do Chile", bolotinhas rosadas facilmente encontrado em pequenas floriculturas ou mesmo em casas de ração é o nitrato de potássio, outros acham que é nitrato de sódio...Mas basta olhar com mais cuidado o rótulo para ver que não é nem um nem outro, mas sim uma mistura dos dois ("salitre duplo de sódio e potássio"). Ao meu ver o termo foi distorcido visto que o nome "Salitre do Chile" se aplica , originalmente , ao nitrato de sódio puro ..Por essa razão as vezes se chama o nitrato de potássio de "Salitre Potássico" ou mesmo simplesmente "Salitre" , para diferenciar do irmão de sódio. Pode não ter muito a ver , mas curiosamente , eu lembro de ter lido que um dos nomes "populares" do nitrato de amônio seria "Salitre da Noruega" , mas isso ,pelo menos aqui no Brasil, não parece corresponder a realidade.
EXPERIMENTAL:
”PURIFICAÇÃO” DE NITRATO DE POTÁSSIO (KNO3) VIA CLORETO DE POTÁSSIO (KCl) E SALITRE DO CHILE ( NaNO3*KNO3 )- "INVERSÃO DO SALITRE"
Note que esse método não é exatamente uma "purificação", mas sim um processo pelo qual se reage o nitrato de sódio presente no salitre do chile com o cloreto de potássio adicionado , para dar mais KNO3 fazendo com que o rendimento seja maior. E isso é muito diferente de simplesmente recristalizar o salitre do chile, sozinho, de modo a obter KNO3. Esse método também funciona , mas eu não recomendaria devido a perdas excessivas no processo. Um método baseado nesse princípio é apresentado em "OUTROS MÉTODOS", mais adiante.
Antes de ver o meu método, olhe o método de um cara do Ad Astra (Ctrl-C/V - sem correções
 ) para ter uma visão geral do processo:
) para ter uma visão geral do processo:=====================================================
=====================================================
=====================================================
1° parte
Colocar para ferver 600g de água, pesar 480g de salitre do Chile e 120g de cloreto de potássio, assim que a água ferver despejar os dois produtos na água fervente e mexer até dissolver as bolinhas do salitre. Logo após dar um choque térmico levando até um tanque e mergulhar essa panela ou caneca c/ os produtos tomando cuidado para não entrar água no vasilhame onde esta os produtos. Feito isso e após atingir a temperatura normal; colocar o vasilhame c/ os produtos no congelador deixando por um período de +-4 horas. Qdo coloco no congelador utilizo um vasilhame de vidro.
Após esse período vc verá que se formou no fundo da vasilha uns cristais.Os cristais é o nitrato de potássio depositado no fundo. Feito isto vc joga fora o restante da água bem – devagar, pois ainda sempre fica um pouco de nitrato na água, logo após vc c/ uma colher – raspa todo esses cristais e coloca num vasilhame p/ ferver novamente e levantando fervura retire do fogo e coe num coador de papel melita. Vc vera que no fundo do vasilhame ira depositar um pó branco que é o nitrato. Se na primeira vez que coar não aparecer o pó não se preocupe as vezes isso acontece é normal.
2° parte
Eu utilizo somente 02 coadores, um no primeiro passo onde se coa toda a borra avermelhada cuidado para não furar o coador senão aquela borra avermelhada não deixa o pó ficar branco. Após terminar a coagem jogue fora o côador e coloque o segundo e vá coando e retirando o pó do fundo do vasilhame, esse processo é feito +- umas 5 a 6 vezes; parar qdo não sair mais pó da água vc verá que água vai ficando bem transparente e não mais leitosa é o sinal que não há mais nitrato na água. Todo o pó que vc vai retirando vá colocando sob um jornal ou papel para sugar toda umidade do produto feito isso forre uma forma de bolo c/ +- umas 6 folhas de jornais ou outro papel absorvente e deposite o pó nela e ponha ao sol para secar.
3° parte
Vá trocando os jornais sempre que perceber o papel encharcado ou bem úmido,isso facilita a secagem.Eu deixo de um dia p/ outro vc vai perceber que fica uma placa grossa bem seca e branca é só esfarelar com os dedos que fica em pó novamente e bem seco.
Obs: para testar se não há umidade retire um pouco desse pó e coloque num guardanapo e espere uns 10 ou 15 minutos se o papel ficar s/ umidade está ótimo pode usar e abusar.
Essa medida que passei da para extrair 200 a 220g de nitrato puro e vc pode também dobrar as medidas para sair mais. Eu uso 1200g de água e 960g salitre e 240g cloreto da para sair 450 à 500g de nitrato puro.
Pessaol à primeira vista parece complicado, mas com a prática vcs verão que não é difícil, no começo eu tb apanhei um pouco conseguia tirar menos nitrato, jogando muita agua c/ o produto fora, é errando que se aprende? ou não? nem sempre!!!!!!!!!!
=====================================================
=====================================================
=====================================================
Foi baseado no esquema básico do procedimento acima e especialmente em outras referências que eu resolvi elaborar a minha própria versão do processo ; Os resultados foram ótimos ; Infelizmente eu havia anotado as proporções e medidas , mas não encontrei o papel de jeito nenhum. Em todo caso , não há maiores detalhes neste processo, embora alguém só descobre esses detalhes tentando o procedimento. No meu método eu costumo usar para cada 1 Kg de salitre do chile uns 0,5 Kg de cloreto de potássio agropecuário (considero ser o salitre do chile 'teórico': 50% do peso em NaNO3, o resto sendo KNO3 + impurezas que desprezo nos cálculos.. Pode parecer um largo excesso de KCl , mas eu não vi nenhum maior problema nessa proporção). Além disso não tenho um controle rígido da quantidade de água.. Vou adicionando água e evaporando conforme quero a separação majoritária de uma ou de outra substância da solução. Em todo caso, lá vai:
USE OCULOS DE PROTEÇÃO , UM AVENTAL E UMA LUVA OU PANO ÚMIDO PARA SEGURAR NOS RECIPIENTES ,QUANDO PRECISO. EMBORA PAREÇA ALGO MEIO "PARANÓICO" VOCÊ DEVE TOMAR CUIDADO PORQUE ESSE PROCEDIMENTO,ASSIM COMO OUTROS, TEM SUAS "ARMADILHAS".. Quando for misturar, se tiver um pouco de paciência, ponha tudo na panela e adicione a quantidade calculada de água (olhando por uma curva de solubilidade) você verá que a panela esfriará bastante (chegando mesmo a condensar água do lado de fora da panela), por causa da dissolução endotérmica dos sais (embora nem tudo se dissolva)..Depois ponha no fogo e deixe ferver..Agora uma parte que é muito perigosa: nas condições de fervura da água a tendência é do nitrato de potássio formado se dissolver todo enquanto que grande parte do cloreto de sódio formado precipita e devido a esse cloreto de sódio o liquido apresentará uma fervura irregular , apresentando a perigosa tendência de “pular” enquanto ferve (esse 'pulo' do líquido faz com que a panela "espirre" líquido quente para todo lado, que pela lei de Murphy pode tender a atingir as mais delicadas partes do seu corpo como sua cara ou mais especificamente seus olhos (por isso é ALTAMENTE recomendado o uso de óculos , avental , etc) e como foi dito esso fenômeno do "pulo" é aparentemente devido aos cristais de NaCl que interferem no processo de fervura ; assim , quanto mais cristais de NaCl formado, pior)..
MUITO cuidado para não se queimar com o liquido quente..Prepare um filtro de café (preferencialmente de pano..filtração mais rápida) , mais um funil BOM (grosso) de plástico limpo (usei um funil de 1500cm3 de capacidade, feito de polipropileno) , em cima de uma garrafa PET ou então você pode desprezar o uso de funil e usar diretamente o filtro de pano apoiado sobre um balde de plástico de qualidade e tamanho suficiente..É muito interessante arrumar algum "apoio" estável que segure com firmeza o filtro de pano por cima do funil, enquanto você adiciona a solução no filtro..Evita a vergonha e o perigo de VOCÊ ter que segurar o filtro enquanto coa a solução fervente. Eu usei garrafa PET como recipiente mesmo e deu certo, mas com um pequeno problema que irei comentar...Agora vá passando , com cuidado, parte da água fervente para esse filtro, para retirar o NaCl (se necessário, adicione um pouco de água na panela, pra compensar o que é evaporado pela fervura da água da solução).. A garrafa PET usualmente irá se retorcer devido ao calor da solução e você deve estar atento a isso para evitar acidentes com o liquido quente (esse foi o maior problema do uso de garrafas PET no meu experimento). Vá fazendo isso até todo o NaCl (e grande parte da merda rosa parafinada) ficar no filtro ( e/ou parte ficar na panela))..Novamente tenho de dizer pra você tomar cuidado com a solução quente , quando ela contem muito NaCl..Ela ferve com violência e “espirra” o liquido quente em todas as direções..Um dos porquês de usarem um pequeno excesso de água.
Ao passar do tempo você verá que pequenas “agulhas” vão precipitando no liquido dentro da garrafa PET a medida que ele vai esfriando.. É o seu KNO3 , ainda impuro em “agulhas” enquanto o NaCl , por ter um sistema cúbico , terá cristais também cúbicos.).. Filtre com um outro filtro de pano de coar café (ou então lave o outro).. Ponha o liquido no congelador..Depois de bem gelado filtre no mesmo filtro o KNO3 adicional que precipitou...
Guarde esses líquidos filtrados, se você pretende fazer mais KNO3 via esse mesmo método (para aumentar o rendimento das próximas vezes, pois o liquido filtrado ainda contem uma quantidade significativa de KNO3 e que não é viável de se ferver para extrair , devido a presença do NaCl e outras substancias indesejáveis) e use no lugar da água de dissolução das próximos/futuros procedimentos.
PURIFICAÇÃO:
Agora pegue o KNO3 e ponha na panela (prévia e devidamente lavada)..Ponha um pouco de água (da torneira serve) e ligue o fogo. Se quando a solução ferver , não dissolver tudo, ponha uma pequena quantidade de água e ferva de novo.. Repita a adição (se for o caso) até tudo dissolver. Vá filtrando rapidamente a solução fervente , do mesmo modo que você havia feito , porém substituindo o filtro de pano usado anteriormente por um outro filtro de pano (limpo), para retirar melhor qualquer impureza que vier (não se esqueça de deixar o resto do liquido no fogo fervendo, com um volume constante de água(adicione um pouco de água, se você ver que muito vaporizou ou começou a cristalizar algum sal na panela), enquanto espera filtrar. Além disso ainda assim é muito vantajoso ter um suporte para o filtro; evita o inconveniente de que você tenha que o segurar para ficar mantendo ele suspenso por um tempo que pode demorar vários minutos). Depois de tudo filtrado, espere esfriar na garrafa e enquanto vai esfriando você deve ir sacudindo a garrafa (com ela fechada) para ir quebrando qualquer crosta de cristais que possa se formar e também eviatndo a formação de "agulhas" muito grandes de nitrato (caso contrário será um pouco difícil de retirar e manusear o nitrato depois, além de que também se tornará dificil de remover todo o líquido intersticial entre os cristais na hora da filtração, mesmo espremendo o filtro manualmente). Depois do líquido ter esfriado ( para a temperatura ambiente) filtre os cristais. Ponha no congelador a garrafa tampada com o liquido filtrado . Espere ficar bem gelado, dê umas sacudidas e filtre de novo...
Esse procedimento é usado para remover o NaCl e outras eventuais impurezas presentes.. Você pode fazer isso uma vez ou mais, dependendo do grau de pureza que você quiser dar ao seu KNO3.. Obviamente , repetindo mais o procedimento de purificação, terá KNO3 mais e mais puro (se quiser usar água destilada para o fazer, sinta-se a vontade, embora eu acho não haver muita necessidade disso se você vai usar para experimentos em casa..(a menos que pretenda tentar fazer um nitrato de potássio de "pureza analítica"
 ), embora você terá um menor rendimento em KNO3..(devido a perdas por dissolução, filtração, parte da solução que pode cair e se esparramar no chão , etc)..
), embora você terá um menor rendimento em KNO3..(devido a perdas por dissolução, filtração, parte da solução que pode cair e se esparramar no chão , etc)..Eu gosto de recristalizar o meu umas 3-4 vezes , como já comentei ,embora seja maçante e trabalhoso, dá um KNO3 bem puro.. Mas acho que umas duas vezes deve ser o suficiente, pra outras finalidades como pirotecnia, fins químicos , etc . Para finalidades como preparação de KNSU para espaçomodelismo , apenas 1 recristalização do material é necessária para fornecer um nitrato de qualidade adequada (existem pessoas mesmo que nem recristalizam o nitrato e ainda assim obtém resultados satisfatórios)
SECAGEM:
Se você quer um KNO3 sem tanta pureza, pode pôr em cima de um papel,jornal ou similar e deixar secar , em finas camadas (de preferência em exposição ao sol, como comentado no método "padrão" apresentado acima).. Esse procedimento eu não realizei pois como disse antes, queria KNO3 mais puro possível...(Porém isso foi tentado por diversos membros de listas e comunidades de foguetismo e reportado de funcionar com perfeição...Quem sou eu para duvidar =).
Do ponto de vista da pureza, uma exposição do KNO3 ao ar livre o deixaria mais impuro, visto que iriam cair ao longo do tempo,com certeza, partículas de fumaça, poeira ,etc em cima dela.
Se você optou por um KNO3 “caseiramente ultra purificado”, basta “espremer” bem o KNO3 no filtro de pano limpo para retirar o máximo de água possível (use as mãos limpas) e ponha numa panela (de preferência uma panela de aço inox, pois panelas de alumínio tendem a reagir com o KNO3 [em solução é difícil de ocorrer, eu mesmo não notei reação nenhuma quando usei panela de aluminio com as soluções ferventes; Mas quando se trata de secar o composto com uma temperatura relativamente alta pode ser diferente {a temperatura pode aumentar muito, mesmo usando o fogo mais baixo possível, que é o que se deve usar nessa etapa}.. Eu também havia tentado isso com uma panela de alumínio e verifiquei que nos pontos da panela {na hora de secagem} onde não se mexia bem e rápido o suficiente {usualmente parte do KNO3 funde durante essa etapa, se não mexido bem}, formava-se uma espécie de película branca fina na panela ,que por não ser solúvel na água e difícil de retirar na hora da lavagem da panela, pode indicar a clara ação oxidante do KNO3 sobre o alumínio...]).
Agora esquente a panela no fogo baixo (bom , o ideal é que se usasse um banho de óleo quente, por sob a panela,para se ter um melhor controle de temperatura , mas por conveniência , por certa maior rapidez e principalmente por certa preguiça eu uso o fogo baixo mesmo.. ) e não se esqueça de mexer BASTANTE na hora em que faz isso, pois geralmente ele dissolve no resto da água intersticial (que você não conseguiu remover espremendo o nitrato no filtro) e tende a “espirrar” o liquido (e numa temperatura muito maior), se for deixado ferver.. por isso cada vez que for observado(não se esqueça dos ÓCULOS!!), retire do fogo um pouco e ponha de novo, rapidamente..Vá mexendo com uma colher e repetindo o procedimento até a água ir evaporando e a coisa tomar a consistência de pó... Agora vá amassando de uma vez as pelotas de KNO3 que se formarem usando a colher e isso vai pulverizando ele na medida que a agua evapora..NÃO DEIXE O KNO3 FUNDIR pois será trabalhoso reduzi-lo a pó depois, visto que vai ficar uma massa dura e que pode ,mesmo ,ser difícil de sair da panela. Depois que você ver que suficiente água foi evaporada, desligue o fogo e deixe a panela , ainda quente, ir esfriando(ele estará “no ponto” quando o pó resultante fiar bem fino e não grudar na colher ou sua mão se for pego (indica ausência de umidade)..Vá pulverizando mais ainda pó usando a colher e quando o pó estiver “morno”, ponha dentro de uma sacola boa , “esprema” a sacola para retirar o máximo possível de ar (deixá-la hermética) e feche-a..Ponha ela dentro de outra sacola e repita, para dar menor contato com o ar (lembre-se o KNO3 ,embora não seja considerado higroscópico, ainda absorve pequenas quantidades de umidade do ar (exemplo: o KNO3 usado para fabricação de pólvora negra COMERCIAL contém usualmente de 1 a 1.5 % de umidade) ..Porém exibe higroscopicidade bem menor que o NaNO3 e outros compostos).
Nessa ultima etapa é exigida muito mais atenção e agilidade.
Pronto (Desculpem... Dessa vez não posso dizer qual foi o rendimento pois perdi as anotações que havia feito. Talvez fique para alguma outra ocasião).
PROCEDIMENTO USANDO SOLUÇÃO 'RECICLADA'
As "águas-mãe" ou "liquores" ou ainda as "soluções residuais" (como costumo dizer) dos procedimentos anteriores foram guardadas em garrafas PET para depois serem usadas em mais uma síntese e que comprovou algumas teorias , já muito conhecidas.
O rendimento, como eu esperava , é vastamente superior ao do usando mera água.. Por que logicamente usando a solução de um procedimento anterior que já possui uma quantidade considerável de KNO3 dissolvido faz com que mais KNO3 precipite em procedimentos similares posteriores com a mesma solução..
Meu rendimento final, partindo de 1Kg de KCl, 2 Kg de salitre do chile e 2,5 L de solução dos procedimentos anteriores foi aproximadamente 1620g de KNO3 bem puro (esse rendimento após recristalizar o produto 3 vezes em água fresca.. o que leva a concluir que se eu tivesse recristalizado apenas uma vez e desconsiderando perdas de um pouco do KNO3 que fica grudado na perede do filtro, respingos ,etc o rendimento seria MUITO superior).. Mas eu sempre prefiro recristalizar varias vezes para eliminar qualquer íons sódio porventura presentes no meu KNO3 (os íons sódio são assassinos de cores nos pirotécnicos..). Sequei KNO3 esquentando cuidadosamente numa panela.
É boa política guardar as soluções para se ter certeza de nada está sendo perdido.
Como ficou inferido, o processo é EXATAMENTE o mesmo do procedimento convencional; a única diferença é que ao invés de água para dissolver o salitre e o cloreto de potássio , se usa a solução residual que sobrou de um procedimento convencional.
BREVES NOTAS:
- Esses procedimentos , na forma que estão escritos, não representam grande coisa, visto que só depois que VOCÊ MESMO TENTAR , verá quais as reais dificuldades possui no procedimento e quais os truques pessoais de química usará para solvê-los ... Veja que eu não estou "induzindo" ninguém a tentar, só estou dizendo que mesmo com este testamento o processo ainda não está 'completamente' catalogado; o porquê do motivo de que tentar ser muito mais elucidativo que simplesmente discutir teoricamente. Portanto o que eu tentei passar foram somente algumas das principais observações , assim como as principais dificuldades que eu tive , como o derramamento casual dos líquidos no chão, entupimento do filtro com cristais na hora de certas filtragens, etc.. Provavelmente no mundo amador a coisa pode se tornar ainda mais ampla e vasta , se por exemplo substituir outros materiais como as garrafas , por exemplo, e eliminar entraves práticos adotando outros procedimentos , pensando e testando soluções.. Em todo caso, a evolução é sempre necessária .
- NOVAMENTE: MUITO CUIDADO PARA NÃO SE QUEIMAR , PROTEJA OS OLHOS (JÁ PENSOU SE ISSO ESPIRRA EM SEU OLHO? CERTAMENTE NÃO SERÁ AGRADÁVEL..SERÁ NOCIVO!) E NÃO FAÇA COISAS QUE SUA CONSCIÊNCIA SABE QUE VAI DAR EM MERDA...PARA QUALQUER COISA DEVE-SE TER BOM–SENSO...
- NÃO É RECOMENDÁVEL USAR FILTROS DE PANO QUE VOCÊ REALMENTE USA OU PRETENDE USAR PARA COAR CAFÉ.. É MELHOR COMPRAR..(É MUITO BARATO E ATÉ NAS LOJAS DE 1,99 VENDE). PORQUE UMA VEZ USADO NO PROCEDIMENTO DE PURIFICAÇÃO (MAIS ESPECIFICAMENTE NA PRIMEIRA PARTE) VOCÊ NUNCA MAIS CONSEGUIRÁ LIMPÁ-LO ; O FILTRO FICARÁ ROSADO PARA SEMPRE!
- Quando você guarda a solução residual desses procedimentos , após algum tempo se verifica que começam a se formar fungos dentro da garrafa, mas a "reprodução" dos fungos não avança e portanto ficam só alguns fungos dentro da garrafa. Quando for usar tal solução no procedimento usando solução reciclada basta filtrar previamente a solução, usando um filtro de papel de café.
DISCUSSÃO DOS RESULTADOS E PROPRIEDADES:
MÉTODO DA "INVERSÃO" DO SALITRE:
BREVÍSSIMO HISTÓRICO E DISCUSSÃO DO PROCESSO:
Por muito tempo, existiu um único metodo de “preparação” em larga escala de nitratos alcalinos , tanto para fins industriais(industria química -> preparação de acido nítrico e certos derivados) quanto para fins agriculturais e bélicos(explosivos, etc) ,etc. Esse método compreendia a extração de nitrato de sódio nos depósitos naturais de certas regiões do deserto do Chile e Peru ( embora ocorrendo também na costa da Bolívia) e que era quase todo exportado para os outros países.
Essa é a razão o nome “Salitre do Chile”( o nome “salitre” vem praticamente , do ponto de vista etimológico , de “salnitre” ou algo parecido que eu não me lembro. Mas que foi evoluindo com o passar do tempo para o que nós conhecemos hoje como “salitre” e com o qual a IUPAC oficializou o nome de “nitrato” (apesar de que o nome "nitrato" já era conhecido bem antes)..
Bom, após ser extraído, esse salitre era beneficiado(levado a uma usina de beneficiamento mineral para sofrer processos como concentração, classificação,etc) para dar algo mais rico em NaNO3 e retirar a impureza , ‘ganga’, de NaCl e também pequenas quantidades de iodato de sódio que eram, depois aproveitadas economicamente (em [13] é mencionado também que pequenas quantidades de perclorato de sódio são extraídas , mas é meio estranho o fato desse sal ocorrer na natureza... Achei (e continuo achando) que somente condições extremamente oxidantes são capazes de gerar esse sal e as únicas que conheço são por via eletrolítica e por via química (usando outras substâncias muito mais oxidantes que o nitrato)..Logo existe um cheirinho de 'fake' nisso..). O nitrato de sódio ordinário é bastante higroscópico.. Porém, o interessante é que se for muito bem purificado e feito livre, TOTALMENTE ,de qualquer sal de magnésio e/ou cálcio, será muito menos (quase não -) higroscopico.. Nitrato de sódio era (e ainda é ) usado principalmente para fins agriculturais e etc..As vezes purificado melhor e usado em pequenas quantidades como agente conservante para carnes,etc. POREM..não era muito bom para explosivos, por isso era necessário a preparação de um outro sal , similar, que não fosse tão higroscópico.. a resposta é o KNO3.
O principio que se baseava o método é muito similar a que nós , experimentadores, fazemos quando seguimos os procedimentos da milagrosa “purificação caseira”(com a exceção de que na industria se usa pressão nas soluções ,para se alcançar maiores temperaturas na água e portanto para dar uma melhor solubilização do KNO3 formado)... O fato é que o nitrato de potássio exibe uma altíssima solubilidade em solução quente, bem maior que o correspondente de sódio, ao passo que nas soluções frias é muito pouco solúvel (menos solúvel que os outros presentes na solução)..Essa propriedade é aproveitada para se fazer a conversão do NaNO3 em KNO3... Isso foi especialmente usado na Alemanha, onde existia uma farta quantidade de KCl e outras substancias sendo extraídas de varias minas e que combinado com o NaNO3 chileno, poderia ser usado para se preparar o KNO3.
O processo geral, se baseia, portanto , na seguinte,resumida e auto-explicativa reação:
NaNO3 (aq) + KCl(aq)
 NaCl(s)* + KNO3(aq)
NaCl(s)* + KNO3(aq)* = verdade apenas para o excesso de NaCl que não consegue se solubilizar mais na água quente, por satura-la..Mas a água contem sim, NaCl(aq).
Depois a solução filtrada , e esfriada para precipitar o KNO3 impuro.. Depois esse KNO3 era dissolvido em água quente e recristalizado quantas vezes fosse necessário para atingir o grau de pureza necessário.. (as soluções residuais eram aproveitadas depois para mais vezes do procedimento)..depois secagem, venda pra outras industrias, etc .
O Brasil ,que possuia uma modesta indústria química (e até hoje, se comparada a outros países) também usava esse método para produzir KNO3 e por aqui o nitrato de potássio sintetizado por esse método era conhecido pelo nome de “salitre de conversão” ou “salitre de inversão” , devido a “inversão” entre o sódio e o potássio na reação acima.
(Um pouco mais tarde , devido as demandas na área de fertilizantes e iminentes guerras a caminho, viu –se a necessidade de se substituir esse método extrativo por outros mais econômicos, que se basearam , quase totalmente , na preparação de acido nítrico via ar (método de Birkeland-Eyde) e subsequente neutralização e mais tarde um ainda mais econômico , compreendendo a produção de HNO3 via oxidação catalítica da amônia usando malhas de Pt ou Pt/Rh (método de Ostwald) e subseqüente absorção/neutralização com uma solução alcalina conveniente).
COMO OCORRE O PROCESSO?
Todas as substâncias envolvidas nesse processo são sais. Mas o que é um "sal"? Se você não matava as aulas de química quando era mais novo deve saber que a palavra "sal" não se refere só ao sal de cozinha (cloreto de sódio), mas sim a uma das principais funções químicas na qual estão incluídas muitas e muitas substâncias com mesmas propriedades.. Mas o que esses sais tem em comum?
Para essa discussão basta apenas dizer que eles são compostos formados de radicais elétricamente carregados (ou simplesmente íons) , sendo os radicais metálicos ( NH4+ é uma exceção) como íons positivos (cátions) e os não metálicos como íons negativos (ânions). Num sal em estado sólido esses dois tipos de radicais se "juntam" firmemente pela atração eletrostática entre eles, que é enorme (em outros tipos de compostos essa atração geralmente é menor). A água tem a capacidade de dissociar esses sais, logo existe uma "quebra" dos íons , mas eles não se separam : a força eletrostática ainda continua a atuar entre eles e de tal modo que mesmo em solução se torna impossível "isolar" um íon positivo de um negativo. Contudo, na solução , ao contrário do que havia no composto sólido, os íons possuem mobilidade. Em outras palavras, os íons tem uma liberdade de movimento na solução, que os permite mudar de lugar e "viajar" com muita facilidade no seio da mesma . Mas devido a atração eletrostática entre esses íons existe uma regrinha básica quando estão em solução: a única condição requerida é de que , em qualquer ponto da solução , a qualquer tempo, cada radical carregado (positivamente ou negativamente) deve estar neutralizado por outro radical com carga oposta.
Então quando você dissolve o nitrato de sódio (NaNO3) e o cloreto de potássio (KCl) numa mesma água, você estará criando uma solução que possui 4 íons distintos: os cátions sódio (Na+(aq)) e potássio (K+(aq) e os ânions cloreto (Cl-(aq)) e nitrato (NO-3(aq)).
Desses íons na solução não só podemos reconstituir os dois sais originais (nitrato de sódio e cloreto de potássio) como também criar dois novos sais: o nitrato de potássio (KNO3) e o cloreto de sódio (NaCl), bastando para isso simplesmente 'trocar' os radicais de lugar. Repare que isso não seria possível misturando o KCl e o NaNO3 em estado sólido (sem dissolve-los em água), pois não haveria como 'movimentar' os íons contidos neles de modo a formar os outros sais. Esse último aspecto pode levar alguém a pensar algo como: "Ora, quando se funde uma substância iônica os íons também ganham "liberdade" de movimento.. Por que não fundir o NaNO3 e o KCl para obter o KNO3 , ao invés de usar água?".. Na teoria pode funcionar bem, mas na prática isso NUNCA iria funcionar, primeiro porque para ambos os materiais serem fundidos, uma alta temperatura é necessária.. Algo próximo a 700-800°C e nessa temperatura (na realidade antes mesmo de se chegar nessa temperatura) o nitrato seria decomposto e você não teria muita coisa. Mesmo se considerassemos que o nitrato não decompõe nessa temperatura, no final você iria ter que usar água de todo jeito para separar o nitrato do cloreto (logo o ato de fundir o material não representou NADA).
Mas voltando a nossa solução com os 4 íons: qual sal pode precipitar da solução? Isso vai depender unicamente das suas solubilidades (que pode variar muito ou pouco em função da temperatura) e logicamente da temperatura da solução.
Para conferir as informações de solubilidade o seguinte gráfico foi extraído de [8] (note que na ordenada desse gráfico aparece "F.M." ; esse acrônimo significa "Formula Weight"(praticamente o mesmo que mol) e representam quantos mols das substâncias no gráfico se dissolvem por 100g de água (praticamente o mesmo que 100mL) a uma dada temperatura.. Nesse gráfico deve ser notado que os números da ordenada parecem mesmo ser "5" , "10" , "15" , "20" e "25", mas na realidade devem ser representados como "0.5" mol , "1.0" mol , "1.5" mol , "2.0" mol e "2.5" mol , respectivamente. Em outras palavras, não faz sentido por exemplo, dizer que mais de "25" mols de nitrato de potássio são solúveis em 100g de água a uma temperatura de 100°C.. Se isso fosse verdade seriamos capazes de dissolver quase 3 quilos de KNO3 em meros 100 mililitros de água!!!). Por esse motivo outro gráfico parecido foi extraído de [9] e é bem melhor que o anterior.
Conhecendo a massa molar das substâncias (na tabela no início dessa página) é possível representar essa quantidade de mols em gramas. Essa interpretação está representada nas tabelas abaixo dos dois gráficos ,com dados extraídos de várias fontes [10][11][12] para melhor precisão, e na minha opinião é bem mais clara para o amador do que os gráficos.. Não só porque mostram a quantidade em gramas para cada substância mas também porque elas possuem dados mais suscintos de solubilidade para temperaturas maiores das que aparecem no gráfico.
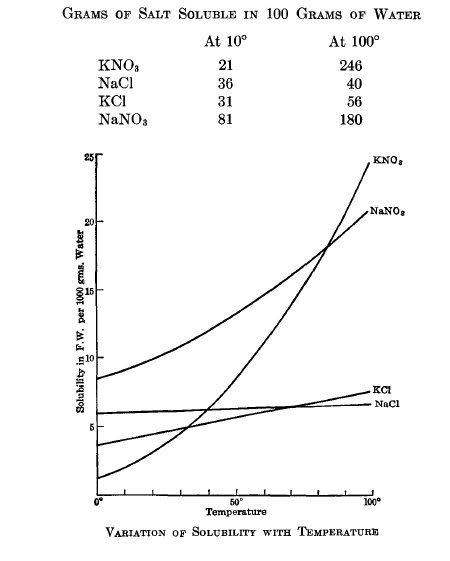
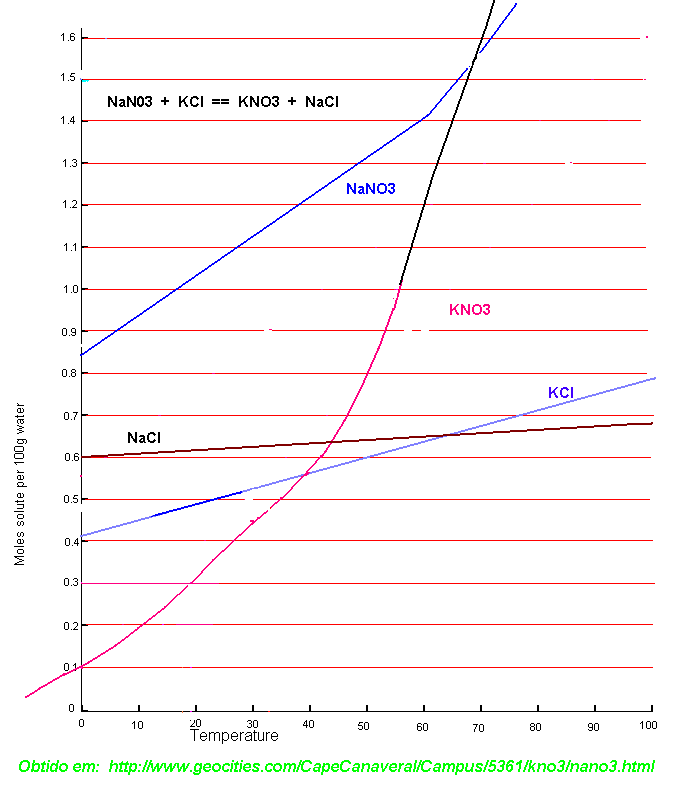
| Temperatura (°C) da solução | Quantidade em gramas de KCl Dissolvido por 100mL de água | Quantidade em gramas de KNO3 Dissolvido por 100mL de água | ||
| 0 | 28,1 | 13,3 | ||
| 10 | 31,2 | 20,9 | ||
| 20 | 34,3 | 31,5 | ||
| 30 | 37,4 | 45,6 | ||
| 40 | 40,4 | 63,9 | ||
| 50 | ? | 85,4 | ||
| 60 | 45,5 | 110,0 | ||
| 80 | 50,6 | 169,0 | ||
| 100 | 56,0 | 245,0 | ||
| 115 | ? | 312,0 |
| Temperatura (°C) da solução | Quantidade em gramas de NaCl Dissolvido por 100mL de água | Quantidade em gramas de NaNO3 Dissolvido por 100mL de água |
| 0 | 35,7 | 72,9-73 |
| 10 | 35,8 | 80,5-80,8 |
| 20 | 36,0 | 87,5-88,0 |
| 30 | 36,3 | 94,9-96,2 |
| 40 | 36,6 | 102,0-104,6 |
| 50 | 37,0 | 112-114 |
| 60 | 37,3 | 122-124 |
| 70 | 37,8 | ? |
| 80 | 38,4 | 148,0 |
| 90 | 39,1 | ? |
| 100 | 39,8 | 175,8-180,0 |
| 110 | 40,4 | 200,0 |
Então, olhando a tabela e os gráficos acima , podemos inferir , por exemplo , que a 10°C , um máximo de aproximadamente 21 gramas de nitrato de potássio puro são solúveis para cada 100mL de água. Logo, se nós conseguissemos manter a temperatura da água constante em 10°C e adicionassemos um largo excesso de cristais de KNO3 puro nessa água , agitassemos bem a solução por um tempo, verificaríamos que filtrando a solução (ainda a 10°C) para remover o excesso de KNO3 não dissolvido , teríamos aprox. 21g de KNO3 dissolvidos por cada 100mL de água. Se contudo, nós tivéssemos posto uma certa quantidade de nitrato puro na água (42g de nitrato de potássio para cada 100mL de água) e tivéssemos aquecido ela a 50°C por exemplo, todo o material se dissolveria. Contudo, resfriando essa solução para 10°C novamente , aproximadamente 21g de nitrato de potássio precipitariam para cada 100mL de água da solução.. E o que sobrou? EXATAMENTE 21g de KNO3 dissolvidos para cada 100mL de água da solução (repare que é a mesma concentração de antes). Logo, não importa o modo que você dissolve um sal na água. Ele sempre se dissolve obedecendo a temperatura vigente.. Podendo se dissolver mais ou menos (ou mesmo permanecendo constante) dependendo da temperatura e de qual o sal é dissolvido (e também pela presença de outros sais, como será dito adiante)..
Uma outra coisa interessante relacionada com a dissolução dos sais é de que a solubilidade de um dado sal é praticamente inalterada pela presença de outro sal na solução, APENAS e APENAS SE , o outro sal "penetra" em questão não possuir nenhum íon (cátion ou ânion) que o outro sal tenha. Por essa razão, as tabelas de solubilidade mutual que aparecem em certos livros costumam ser sempre de sais que contenham um ou outro radical em comum. Por exemplo, solubilidade mutual de sulfato de sódio e cloreto de sódio (sódio em comum); carbonato de sódio e carbonato de potássio (carbonato em comum), etc (quando aparecem em tabelas desse tipo sais sem íons em comum então é devido a outra característica, que é própria daqueles sais.. Por exemplo: compostos de cálcio tendem a ser mais solúveis em certos compostos amoniacais, mesmo não tendo nenhum redical em comum ; etc)
Então, pelo que dá pra perceber (ÓBVIO), o NaNO3 e o KCl são sais completamente diferentes, isto é, eles não possuem nenhum íon em comum. Então considere que essas substâncias , em quantidades equivalentes (em mols) tenham sido adicionadas numa dada quantidade de água e tenham se dissolvido completamente , a uma dada temperatura (lembre-se, quando esses dois sais se dissolvem na água, 4 íons distintos aparecem na solução: Na+(aq) , K+(aq) , Cl-(aq) e NO-3(aq)). A quantidade dos sais adicionada foi tal que a quantidade total de K+ e NO-3 fosse de 42g para cada 100mL de água. Agora a solução é resfriada para 10°C. O que aconteceu? Ora, para cada 100mL de água da solução, cerca de 21g de KNO3 precipitaram. Portanto por esse resultado e a comparação com os anteriores, pode ser comprovada que a presença dos radicais Na+(aq) e Cl-(aq) (agora formando NaCl na solução) não tiveram nenhum efeito na solubilidade do nitrato de potássio..(adaptado de [8])
Então, para aproveitar essas informações da melhor maneira possível no cenário amador, basta ter a mão algumas simples informações:
- A reação: NaNO3 (aq) + KCl(aq)
 NaCl(s) + KNO3(aq) (apenas posta aqui para finalidades ilustrativas, visto que essa reação está inferida aqui MILHARES de vezes, caso não tenha percebido
NaCl(s) + KNO3(aq) (apenas posta aqui para finalidades ilustrativas, visto que essa reação está inferida aqui MILHARES de vezes, caso não tenha percebido  )
) - Se você usa substâncias puras ou impuras ; logicamente se você usa substâncias puras como precursores (ou seja, nitrato de sódio puro e cloreto de potássio puro) os cálculos (quantidade de água necessária, etc) , além da purificação do KNO3 ficam vastamente facilitados; Contudo, é muito difícil encontrar material puro fora de lojas de química especializadas (e isso impede que seja um método artesanal, realmente divertido =), além disso sai MUITO mais caro também.. Então a saída é utilizar o bom e velho salitre do chile e cloreto de potássio agrícola (ambos encontrados na forma de adubos químicos). É muito mais barato, contudo dificulta a purificação e os cálculos da quantidade de água requerida (embora eu tenha visto que dependendo, na prática, de como você vai dissolvendo os sais, isso acaba não importando tanto). O salitre do chile por exemplo, usualmente vem com o nome "nitrato duplo de sódio e potássio" escrito no rótulo. Algumas vezes ainda (como no meu caso) vem com informações de que o material contém "50% de nitrato de sódio e 50% de nitrato de potássio".. Eu tomo por padrão exatamente isso; mesmo sabendo que o salitre , na realidade , não costuma obedecer assim tão certinho as proporções que vem nos rótulos; inclusive como foi comentado por alguém em [6], mesmo um mesmo lote do material pode apresentar porcentagens diferentes.. Mas isso não me importa muito, pois eu costumo pôr ligeiro excesso de KCl, só para garantir. Já esse cloreto de potássio eu considero com uma pureza máxima de 80-90%, sendo as impurezas NaCl, sais de magnésio e até mesmo uma "cera" insolúvel que costumam misturar em alguns tipos do adubo.. Isso detona com qualquer filtro..
- As informações de solubilidade das substâncias envolvidas (vide tabelas acima).. Pra ser sincero as informações desse tipo que são realmente úteis no mundo amador são as solubilidades referentes à máxima (100°C) e à mínima (0°C) temperatura, apenas porque são as que você pode facilmente assegurar sem nenhum termômetro (popularmente, "no olho").. Assim ,as tabelas e gráficos monstruosos e tudo mais acima pode ser simplificado nessa pequena tabelinha:
Temperatura (°C) da solução Quantidade em gramas de NaCl Dissolvido por 100mL de água Quantidade em gramas de NaNO3 Dissolvido por 100mL de água Quantidade em gramas de KCl Dissolvido por 100mL de água Quantidade em gramas de KNO3 Dissolvido por 100mL de água -0- 35,7 72,9-73 28,1 13,3 -100- 39,8 175,8-180,0 56,0 245,0
Basta apenas observar o tipo de material que você vai usar (se é puro ou não.. Fazer os ajustes cabíveis da quantidade é tarefa de quem faz o procedimento) e fazer o procedimento de tal modo que a solução esteja sempre saturada ou próxima da saturação (para evitar perdas), além de notar que existem dois fatores, um ocorrendo na fervura da solução e o outro no resfriamento da mesma: se por um lado você mora acima do nível do mar , a temperatura de ebulição da água tende a ser menor que 100°C fazendo com que as quantidades de sais dissolvidos na água fervente sejam ligeiramente menores que os da tabela; Por outro lado a água tende a ferver a uma maior temperatura quando está com muito sal dissolvido.. Talvez esse último efeito sobrepuje o primeiro fazendo com que você não tenha que se preocupar muito.. Por via das dúvidas, adicione uma quantidade ligeiramente maior de água do que a teórica, até porquê , durante a fervura parte da água é perdida por evaporação devido ao aquecimento da água e você precisa ir pondo mais água durante o processo, para repor a que evaporou e evitar que algum material indesejável precipite precocemente.
Já no resfriamento, é tranquilo.. Após ter filtrado o NaCl indesejável que precipitou, deixe a solução resfriar naturalmente, os cristais de nitrato de potássio vão aparecendo e após a solução resfriar na temperatura ambiente, filtrar os cristais, expremer os mesmos no filtro para remover o máximo de líquido residual e guardar ; pôr a solução filtrada no congelador.. Quando ela estiver bem fria, uma quantidade muito maior de nitrato (impuro) terá precipitado, agora basta filtrar , remover o máximo de líquido residual dos cristais e pôr os cristais filtrados junto com os cristais obtidos anteriormente anteriores.. Outra coisa no resfriamento a ser notada é que a maioria dos congeladores comuns conseguem atingir temperaturas inferiores a 0°C.. Isso com toda certeza ajuda no processo, visto que ainda mais nitrato tende a precipitar.. - Recristalizar o material , pelo menos uma vez, é ALTAMENTE recomendável por todos que realizam esse procedimento.. Desde a indústria até os loucos espaço modelistas
 ; Isso evita uma série de inconvenientes.. Porquê o nitrato de potássio obtido, se não recristalizado, não é muito puro.. Contém ainda muito cloreto e sódio presente junto (além de poder apresentar ainda outras impurezas)..
; Isso evita uma série de inconvenientes.. Porquê o nitrato de potássio obtido, se não recristalizado, não é muito puro.. Contém ainda muito cloreto e sódio presente junto (além de poder apresentar ainda outras impurezas)..
A recristalização é um meio simples de eliminar essas impurezas.. Basta dissolver o nitrato impuro numa dada quantidade de água fervente, filtrar ainda quente e esperar a solução esfriar e parte dos cristais precipitarem(após filtrá-los e expremê-los no filtro, basta novamente pôr no congelador, como feito anteriormente.. Após a temperatura da solução ter sido ainda mais diminuída, basta filtrar o restante dos cristais e pronto...).
Cada vez que esse processo é repetido, mais puro o nitrato de potássio fica, contudo o rendimento vai diminuindo, visto que parte se perde dissolvida na solução (como pode-se ver na tabela acima, a 0°C ficam 13,3g do nitrato dissolvidos na solução para cada 100mL de água usadas). Contudo, você pode guardar todas essas soluções filtradas, que contém apreciáveis quantidades de nitrato de potássio, e usá-las como solvente para o salitre/KCl, da próxima vez que for converter mais salitre em KNO3; com essa política você evita perdas. - A secagem do material pode ser feita tanto ao ar livre, quanto ao sol, como muitos fazem ou mesmo na própria panela (aquecendo com MUITO cuidado).. Pode-se usar qualquer um desses métodos... O que vai influenciar na escolha de cada um é simplesmente a pressa que você tem que o nitrato seque e da pureza do material desejada. Eu usualmente seco aquecendo com muito cuidado na panela, na chama mais baixa possível e mechendo vigorosamente com a colher, para evitar que o nitrato que está no fundo da panela se funda e também com o objetivo de homogeneizar o calor distribuído à massa de nitrato, facilitando a secagem.. Eu sempre escolho assim porque quero um material puro e também não tenho paciência para esperar secar naturalmente... Nos outros métodos, quando o material é deixado para secar naturalmente, ele vai ficando cada vez mais impuro, visto que caem poeira e outras porcarias por cima , carreadas pelo vento.. E deixando exposto fora de casa (ao sol, por exemplo) ainda tem-se o perigo de que , de uma hora para outra , o tempo vire e comece a chover.. Aí você poderá ver todo o seu esforço indo por água abaixo!!! ahaaha
O KNO3 ao contrário de vários outros nitratos (inclusive o de sódio) é um sal muito pouco higroscópico (higroscopia é a tendência de uma substância em "absorver" humidade do ar) DESDE QUE PURO E LIVRE DE OUTROS ÍONS (sódio, amônio, etc), logo um método simples para se verificar grosseiramente a pureza do nitrato de potássio obtido é ver se ele fica "molhado" se exposto certo tempo ao ar livre. Se ficar consideravelmente "molhado" significa que o nitrato obtido não é puro ; caso o nitrato não absorva água do ar (ou absorver bem pouca) , pode-se considerar KNO3 de boa pureza. No meu caso não se observou umidade significativa no KNO3 obtido tanto no método "convencional" da inversão quanto no método usando soluções residuais para a inversão. Aprovado nesse quesito!
Quando algum sal oxidante de potássio (como o nitrato) queima junto com certas substâncias ele emite uma tênue , mas bela luz violeta/lilás QUANDO LIVRE de contaminação por sódio e alguns outros íons. Se o sódio, por exemplo, está presente numa mistura pirotécnica de luz colorida (azul, verde, etc), mesmo em pequenas quantidades, a luz amarelada que o sódio gera é suficientemente forte para "varrer" a luz criada por várias substâncias para dar a cor desejada na luz da mistura, logo o sódio é um verdadeiro "ASSASSINO" de outras luzes coloridas. Como a luz violeta do potássio é bem "fraquinha" ela é praticamente eliminada pelo sódio, mesmo este último estando presente em pequenas quantidades.
Então, baseando-se nesse fato, outro experimento realizado para comprovar a pureza do KNO3 (produzido via "inversão de salitre" da parte experimental (acima)) de íons sódio foi fazer dois testes : um teste usando o nitrato de potássio obtido no procedimento original e outro obtido no procedimento usando solução residual . Foram feitas e testadas 50g de KNSU tradicional (30g KNO3/20g açúcar)em cada um. Em ambos os casos realmente eu não consegui observar qualquer contaminação de íons sódio significativa.. O que é uma excelente notícia para o pirotecnista amador!
Se você olha dentro da chama na hora da queima vai ver a chama amarelada, mas não é devido ao sódio não.. Isso é por causa da oxidação do carbono da molécula de sacarose.. A cor 'real' aparece em volta da chama, tipo como uma 'aura'.. Que é lilás típica de potássio "puro" (o que signfica em termos grosseiros que o KNO3 obtido é bastante puro
 )
)Woo Hoo!!!
Logo conclui-se que não há contaminação significativa , no KNO3 , obtido pelo processo de "inversão" do salitre, de íons sódio. Portanto teoricamente a "impureza" que pode estar possivelmente presente seria cloreto . Até o presente momento não realizei nenhum teste (argentométrico por exemplo) para verificar se o nitrato está livre de cloreto, embora eu esteja bem certo de que não há praticamente nenhum cloreto no material. Se houver cloreto , deve ser o cloreto que estava presente na água de torneira que usei para dissolver o material ; Logo outra conclusão é que , se eu houvesse utilizado , ao menos na ultima recristalização, água destilada, o nitrato de potássio iria ser provavelmente , completamente livre de cloreto, sódio ,etc.. Mas acho que essa frescura toda não necessária =]. Em todo caso, quando tiver um pouco de AgNO3 e lembrar eu faço o teste e ponho aqui o resultado..
Outros métodos, no mínimo curiosos, para analisar a pureza do nitrato de potássio são descritos mais suscitamente em [7]. São métodos BEM antigos, que foram usados a bastante tempo e que hoje em dia são praticamente obsoletos comparando-se com os métodos atuais. Em todo caso eles não deixam de usar a lógica, além de servirem como outras opções, especialmente para os que levam ao pé da letra a palavra "artesanal". kkkkkk
Um dos tais métodos é baseado num processo simples , de que um sal não se dissolve numa solução saturada do mesmo sal, mas outros sais podem se dissolver com certa facilidade(isso já foi dito na seção da explicação do processo de inversão do salitre). O método é o seguinte: uma certa quantidade de solução saturada e pura de nitrato de potássio é misturada a certa quantidade (pesada) do nitrato de potássio sólido (em pó bem fino) que se deseja ver o grau de pureza. A suspensão resultante é agitada por alguns minutos e então o nitrato sólido é filtrado e o processo é repetido mais uma vez, ou seja, esse nitrato filtrado é adicionado numa outra solução de nitrato de potássio saturada e pura, a suspensão é agitada por algum tempo e filtram-se novamente os cristais de KNO3. A massa de cristais sólidos assim obtida é fortemente expremida no filtro para remoção do líquido intersticial e então é secado e pesado; a diferença no peso do nitrato antes do processo e o do final do processo corresponde a quantidade de impurezas solúveis presente no dito nitrato.
Um outro método consiste em se converter o nitrato de potássio completamente em carbonato de potássio, usando para isto carvão (na presença de grande excesso de NaCl), fazendo a mistura e pondo pequenas porções por vez num recipiente metálico adequado e aquecendo fortemente ; depois as "cinzas" resultantes são dissolvidas em água e filtradas, a solução resultante é titrada usando-se um ácido qualquer de concentração conhecida (sulfúrico, clorídrico, etc), até a neutralização. A reação do nitrato de potássio com o carvão TEM que ocorrer na presença de algum agente inerte (como o cloreto de sódio, NaCl), caso contrário (apenas carvão e nitrato, sem o agente inerte)a reação pode ficar muito perigosa e difícil de controlar.
Certamente esse não era o método de análise de pureza preferido na época , devido a possuir uma baixa acuracidade relativa, além de representar certo risco.
OUTROS "MÉTODOS":
Diversos métodos tem sido apresentados na internet.. A maioria deles devido a preguiça individual de pesquisar a boa informação, por isso saem coisas ridículas.. Especialmente métodos como "KNO3 a partir de fezes , terra e cinzas". As pessoas simplesmente pensam que , como não conseguem encontrar "KNO3 100% puro" na loja mais próxima (Como se elas realmente fossem encontrar ahahaha), podem tentar esse método e obter o maior rendimento de nitrato puro e cristalino..Um redondo engano. Nem precisa tentar você mesmo para ver o porquê..(Nota: não estou dizendo que não funciona..Só estou dizendo que não é prático. Provavelmente vai funcionar para alguém, mas o rendimento pode ser tão pífio e o produto tão impuro que a impressão que a pessoa vai ter do método é de que não funciona. Esse seria algo como métodos para pessoas realmente desesperadas e que não tem nenhuma outra alternativa, portanto pode ficar tranquilo =).
Os seguintes métodos que eu apresentarei a seguir são apenas para mostrar o que rola na internet. SIMPLES CTRL-C/CTRL-V.. Siga-os apenas se você quiser perder seu tempo , não tiver nada mais interessante para fazer ou por algum motivo estiver realmente interessado em estudar o método sob algum aspecto e quiser aperfeiçoá-lo de fato (o que seria em termos 'acadêmicos' EXTREMAMENTE interessante) ..
=====================================================
=====================================================
=====================================================
PROCESSO ARTESANAL PARA OBTENÇÃO DE NITRATO DE POTÁSSIO
(nome do indivíduo preservado : autor "anônimo")
Sou uma espécie de químico de final de semana. Como todos sabem a primeira coisa que um químico precisa é o material para as esperiências, como a maior parte das minhas é com polvora, sinais de fumaça, e coisas do tipo, o ingrediente que mais uso é o KNO3 (nitrato de potássio) cansei de ficar comprando nitrato de potássio (quase sempre impuro) em lojas de adubos, decidi então me empenhar em descobrir um jeito de produzir nitrato de potássio artesanalmente sem utilizar nenhum material complicado ou de difícil aquisição. O processo que desenvolvi é de fácil realização, podendo qualquer um, com interesse e curiosidade em química facilmente realizar.
Material:
Um balde de metal;
Papel filtro (daqueles de café);
Cinzas de madeira ou de cigarro (de preferência de cigarro);
Água;
Terra;
Fezes (não estranhe, as fezes são parte crucial do processo).
Preparação dos materiais:
1º Encha cerca de meio balde de terra onde hajam fezes de algum animal (de preferência de vaca), quanto mais tempo as fezes repousem na terra melhor.
2º Em um recipiente aparte, misture água com as cinzas (lembre-se quanto mais cinzas, maior a concentração da solução).
Realização:
1º Complete o balde de terra e fezes com a solução de água e cinzas;
2º Ferva a mistura por cerca de 30min;
3º Passe o filtro pela água, o filtro estará impregnado com nitrato de potássio;
Explicação:
Nas fezes há substancias que são digeridas por bactérias presentes na terra, dando origem à nitratos. As cinzas ao reagirem com a água, dão origem à hidróxido de potássio (potassa cáustica).
Ao se ferver tudo isso, os nitratos reagem com o hidróxido de potássio, originando nitrato de potássio e diversos hidróxidos, isso acontece pelo fato de o potássio ser muito mais reativo do que os metais presentes nos nitratos obtidos pela digestão das fezes pelas bactérias.
=====================================================
=====================================================
=====================================================
Sobre o procedimento, o autor do mesmo diz o seguinte:
----------------------------------------
RESPONDENDO
1º DEIXE AS FEZES NA TERRA POR CERCA DE DUAS SEMANAS;
2º QUANTO MAIS CINZAS MELHOR;
3º FUNCIONA SIM, JA DESTILEI CERCA DE 200G DE kno3
----------------------------------------
Eu particularmente sou cético quanto ao processo; não sou ninguém para julgar, mas acho que coisas muito 'esquisitas' aparecem nesse procedimento..Como por exemplo o fato do cara ter obtido 200g de nitrato.. Isso não parece muita coisa ,mas nesse procedimento é IMPOSSÍVEL obter essa quantidade em tão pouco tempo (2 semanas).. Os processos usuais de nitrificação costumam demorar meses ou mesmo alguns anos para se completarem ; além disso os termos "destilei" e outros no texto não ajudaram muito na confiabilidade do método..
Um outro procedimento similar, do suposto Improvised Munitions Handbook [4] é o seguinte:

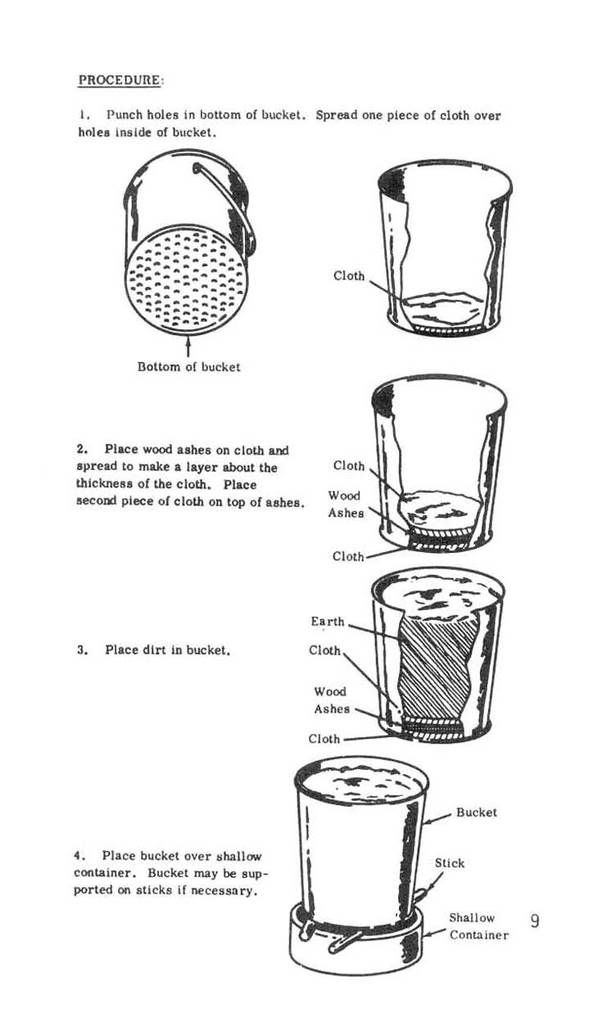

O método descrito em [5](veja a página do cara) é um dos que eu acho mais engraçados.. Não há dúvidas de que dá certo, mas o que eu acho engraçado é que há mais misticismo do que realmente uma simples operação para obter KNO3.
E se não estou enganado esse cara usa como precursor nitrato de potássio para "revificar" e obter o próprio nitrato de potássio(?!?!). Qual o motivo de dissolver o KNO3 em mijo de vaca, pôr num pote cerâmico para esperar cristalizar do lado de fora , para dissolver em água e recristalizar em água de chuva para obter..... KNO3????????????? Ora ele já tinha o nitrato de potássio antes de tudo!
Como os links não são tão confiáveis(o link em [5] pode falhar algum dia, nos privando dessa fonte maravilhosa de risos), o método encontrado em [5] está imortalizado na imagem seguinte:

O gráfico não está tão bom , mas ao menos eu tentei
 . Se quiserem ter uma melhor visualização, basta ir em [5] nas referências e conferir..
. Se quiserem ter uma melhor visualização, basta ir em [5] nas referências e conferir..Não posso resistir a tentação de deixar gravado aqui uma parte de outra discussão sobre esse "método":
=====================================================
=====================================================
=====================================================
Autor: "X" (preservando o nome)
título do tópico: "Tradução"
Texto:
Alguem poderia traduzir esse texto pra mim por favor? Ta meio confuso, o que dificulta o entendimento.
No meu caso entendi pouco, mas se alguem puder ler e resumir o procedimento ou até mesmo apresentar um procedimento parecido eu agradeço!
"PETRINUS"
O texto se trata da produção de Nitrato de Potássio utilizando a urina!
=====================================================
=====================================================
=====================================================
O site que o cara postou acima é o [5] das referências(imortalizado na figura acima). Logo depois veio uma outra pessoa e postou o seguinte:
=====================================================
=====================================================
=====================================================
??
se quer traduzir isso pra q? quer ler em japones, ingles, alemão ou o q? já ta em portugues fi.
bom... aqui na comu ja tem um troço explicando isso, da uma procurada ae
=====================================================
=====================================================
=====================================================
Uma palavra sobre o comentário: KKKKKKKKKKKKKKKK!!!!!!!!!!!!



Pô!! Os caras são mestres na zoação! Eu ri demais quando eu li isso..
Um outro método ainda mais absurdo e que foi proposto por outras pessoas seria a reação entre cloreto de potássio(aq) e nitrato de prata(aq).. O cloreto de prata , praticamente insolúvel, é formado , separado por filtração ou outro método conveniente e a solução onde resta o KNO3 , praticamente pura é evaporada a secura e o nitrato de potássio extraído.
Não há dúvida de que a reação:
KCl + AgNO3
 AgCl + KNO3
AgCl + KNO3 funciona perfeitamente... Mas vamos supor que você pretenda fazer meros 1Kg de KNO3 através desse método.. Pela reação você pode ver o seguinte:
A massa molar (MM) do AgNO3 é aprox. 169,9g/mol , e a do KNO3 é 101,1g/mol.. Então para fazer 1Kg de nitrato de potássio com 100% de eficiência , você vai precisar de aproximadamente 1.680,51g (mais de mil seicentos e oitenta gramas) de AgNO3 100% puro.
Tente comprar essa quantidade de nitrato de prata e vai ver o porquê desse método não valer a pena.. ehehe considerando o preço de 100g de nitrato de prata como sendo o de cem reais (esse definitivamente não é o preço real do AgNO3 comercial.. É uma especulação que eu estou fazendo do melhor cenário possível.. Se me recordo bem , lembro de ter visto o preço como sendo algo superior a R$ 200,00 por 100g !) você gastaria no geral quase R$ 1.700,00 para no final obter 1 Kg de KNO3.. Insano! Mesmo que você fizesse o seu próprio nitrato de prata (que ficaria muito mais barato que comprar) via HNO3 + Ag , ainda assim o preço seria proibitivo..Além do mais, porquê gastar ácido nítrico fazendo isso se você pode fazer o KNO3 diretamente, bastando apenas adicionar hidróxido ,carbonato ou algum outro composto de potássio ? Ainda assim , porquê gastar nitrato de prata fazendo nitrato de potássio? O AgNO3 possui MUITO maior utilidade e valor do que o KNO3..
Portanto, sob todos os aspectos , fica provado que esse método , para produção de KNO3 , não presta.. Entretanto, de uma outra maneira ele pode ser útil para verificar a pureza de seu KNO3.. O conhecido teste argentométrico.. Por exemplo, imagine se você desejasse verificar se o seu KNO3 (assim como várias outras substâncias) está livre de contaminação de cloretos. O que fazer? Simples. Basta fazer uma solução com o seu nitrato de potássio "100% puro" e uma outra solução (obviamente em pequena quantidade) com um pouco do seu nitrato de prata.. Adicione umas gotas dessa solução de nitrato de prata recém preparado na solução de KNO3 , se não formar nenhum precipitado, significa que seu KNO3 é mesmo "puro"(pelo menos do ponto de vista de que não contém quantidades expressivas de cloretos, sulfatos,etc) , se formar algum precipitado, significa que existem outros ânions junto com o nitrato, tipo cloreto , sulfato,etc..
Muito provavelmente esse precipitado de AgCl, se ocorrer, será do tipo coloidal, logo pode se tornar um pouco difícil de ver a olho nú.. Mas você pode usar um 'truque' para contornar esse problema, que é o uso do Efeito Tyndall para detectar o precipitado. Basta direcionar luz focalizada no recipiente ou mesmo um laser (desses de luz vermelha de brinquedo). Se você não ver a luz passando pelo recipiente (não ver a luz passando pela solução), significa que o seu KNO3 não contém nenhum cloreto como impureza (logo, é bem puro, ao menos nesse aspecto). Caso contrário significa que o seu KNO3 contém cloreto como contaminante.
O método mais ÓBVIO seria o que eu mencionei acima e que várias pessoas com toda certeza já pensaram algumas vezes: o de reagir diretamente ácido nítrico e hidróxido(ou carbonato) de potássio, para se ter um produto de boa pureza..
O "anônimo N°2" havia postado isso no mesmo fórum onde o outro "anônimo" postou o método "bosta de vaca + cinzas e terra", copiado acima).
Acompanhem a discussão entre as duas pessoas abaixo.. Copiei e passei para cá , fielmente e sem correções gramaticais , com o intuito de deixar para a posteridade.. (Vocês vão se divertir pra valer lendo isto!
 ) :
) :Título: "KNO3 - Nitrato de potássio"
Por: "anônimo n° 2"
=====================================================
=====================================================
=====================================================
Caros colegas,
vi por aqui vários métodos realmente "artesanais" de praparo de KNO3. Para quem não tiver a paciência de tentar algum destes métosos arcaicos e de baixo rendimento, aí vai a receita mais científica possível (dentro dos limites do possível para amadores!)
Comprar:
Ácido Nítrico
Hidróxido de Potássio
Estes produtos tem venda controlada, o que não quer dizer que não se pode comprá-los. A venda é limitada a 2 litros ou Kg por cliente por mês, o que é mais que suficiente para produzir uma grande quantidade de KNO3! Vc só precisa ser maior de 18 anos e possuir CPF para efetuar a compra em qualquer loja de produos químicos. Em pureza comercial, o Kg ou litro destes produtos não custa mais que 10 reais.
Procedimento:
As quantidades dependem da concentração do ácido adquirido:
Para cada 500g de hidróxido, vc precisará:
HNO3 53%: 1059,5 g ou 796,5 ml
HNO3 60%: 936 g ou 684,5 ml
HNO3 70%: 802 g ou 569 ml
Em um recipiente limpo de vidro adicionar a quantidade necessária de ácido, e LENTAMENTE adicinar PEQUENAS QUANTIDADES de hidróxido. CUIDADO, a reação é violenta, use luvas de borracha (não use luvas cirúrgicas descartáveis!)camiseta de mangas compridas e calças (de preferência guarda-pó de algodão!), e óculos de segurança!!!
A reação de neutralização libera muito calor, deixe o recipiente de preferência, em banho de gelo, para evitar a ebulição do ácido.
Assim que tiver adicionado quase todo o hidróxido, controle o pH com papel indicador, se após adicionar tudo, a solução estiver muito ácida (pH menor que 6), adicione pequenas quantidades de KOH, até a neutralidade (pH=7). Caso a solução esteja básica (pH maior que 7), adicione pequenas quantidades de ácido. É muito importante que a solução não fique básica, pois haveria contaminação indesejada com hidróxido no KNO3. Um pequeno excesso de ácido é facilmente eliminado posteriormente.
Assim que o pH estiver controlado (a solução deve ser INCOLOR), filtre a solução caso haja impurezas ou sujidades.
IMPORTANTE: caso a solução esteja colorida, mesmo que apenas levemente, ou apresente muitas partículas de sujeira, NÃO CONTINUE ! a oxidação da matéria orgânica possivelmente presente poderia causar uma violenta explosão!!!!
Esta solução incolor e limpa de KNO3 está pronta para ser evaporada para eliminar a água e o excesso de ácido.
Em uma panela de aço (não use alumínio!!!!) aqueça a solução lentamente, até entrar em ebulição. ATENÇÃO: faça ao ar livre, e não na cozinha, pois será liberado ácido nítrico, tóxico e corrosivo!
Há duas maneira de proceder daqui para frente: para obter cristais de KNO3 de alta pureza, não evapore toda a solução, apenas reduza 2/3 do volume e deixe a solução esfriar LENTAMENTE e em REPOUSO. assim, quando a soluçãoe estiver fria (pode por na geladeira) vc poderá separar os cristais e descartar o restante. Seque bem os cristais, moa e aqueça para eliminar a água (não mais que 100 graus).
Para obter o máximo possível de nitrato não tão puro (o mais lógico, se for usar em pólvora, por exemplo), aqueça a solução até a secura, não deixe esquentar demais!!!! assim que formar-se uma massa pastosa desligue o aquecimento, e retire o produto. deixe esfriar, moa bem e aqueça lentamente mexendo sempre, até secar bem. CUIDADO: esta etapa é muito perigosa, pois pequenas quantidades de matéria orgânica podem causar explosões!!!
O KNO3 está pronto para o uso, guarde em frasco bem fechado. Para cada 500g de hidróxido, obtem-se cerca de 900g de nitrato!
ATENÇÂO: estas informações são meramente didáticas, não me responsabilizo por danos ou acidentes decorridos de sua utilização!
Siga sempre as normas básicas de segurança e proteção!
SDS
JEFCG
=====================================================
=====================================================
=====================================================
Resposta por "anônimo"
Título: "ARCAICO É UMA PINÓIA!!!!!" (abaixo)
=====================================================
=====================================================
=====================================================
SE VOCÊ CONSIDERA O MÉTODO QUE DESENVOLVI NÃO É MUITO EFICAZ, É PORQUE NÃO COMPREENDE A SATISFAÇÃO QUE SE TEM AO PRODUZIR ALGO COM ESFORÇO E DEDICAÇÃO.
JA QUE VOCÊ GOSTA DE APONAR FALHAS EM TEORIAS E PROJETOS, VEJAMOS OMO ACEITA UMA CRITICA CONSTRUTIVA SOBRE SEU MÉTODO:
1ªFALHA:VOCÊ DIZ QUE A VENDA É POSSIVEL, CONTUDO, NÃO INDICA NENHUM LOCAL OU SEQUER MOSTRA O RAMO DO ESTABELECIMENTO EM QUE SE PODERIA ACHAR TAL PRODUTO;
2ªFALHA: MESMO QUE SE SOUBESSE ONDE COMPRAR TERIA DE TER MAIS DE DEZOITO, O QUE EXCLUI GRANDE PARTE DOS INTERESSADOS NESSA ÁREA;
3ªFALHA: MESMO SE LGUEM ESTIVER DENTRO DESSE PERFIL QUE POSSA COMPRAR O KNO3, SERIA CARO DEMAIS PRA VALER APENA
ME DESCULPE SE FUI ASPERO OU INDELICADO, É QUE NÃO FICO MUITO FELIZ QUANDO TENHO MEUS PROCESSOS POSTOS EM DÚVIDA, MAS ESTOU SEMPRE ABERTO A RECEBER CRITICAS CONSRUTIVAS, ESPERO QUE NÃO ME CONSIDERE COMO ALGUEM APENAS CRITICANDO, MAS MOSTRNDO QUE ALEM DE MAIS BARATO O MEU PROCESSO É TAMBÉM MAIS EMOCIONANTE E DIVERTIDO.
VOCÊ ME PARECE ALGUÉM COM UM NÍVEL INTELECTUAL APRIMORADO, ESPERO PODER TROCAR SUGESTÕES E IDÉIAS COM VC.
=====================================================
=====================================================
=====================================================
Resposta: "Caro "anônimo""
Por: "anônimo n°2": (abaixo)
=====================================================
=====================================================
=====================================================
Primeiramente, aceito suas desculpas, pois você foi "ápero e indelicado" sim, e sem necessidade alguma!
Convenhamos, de um ponto de vista científico, o seu método é aracaico SIM! Isso não é desmerecer a sua pesquisa, ou mesmo o próprio método.
Te invejo pela capacidade de desnvolver este método (e outros que li por aí) e chegar a bons resultados com eles. Não duvido nem um pouco que você realmente tenha satisfação em executar as muitas e por vezes complexas etapas dos procedimentos que desenvolve. Só posso te parabenizar por isso, afinal, é sobre um hobby muito recompensador que estamos discutindo...
NO ENTANTO, quis apresentar uma alternativa mais rápida, simples e direta para a obtenção do KNO3, destinada aos que querem gastar seu tempo na UTILIZAÇÃO deste composto, e não na sua OBTENÇÃO! Acho que foi justamente este aspecto que vc deixou de apreciar em minha mensagem.
Repito, em instante algum pretendi desmerecer seu trabalho!
Quanto às falhas que vc apontou no "meu método":
1) Lojas de produtos químicos e artigos para laboratórios são facilmente encontradas nas páginas amarelas de qualquer lista telefônica.
2) O fato de ter que ser maior de 18 pode dificultar, mas não exclui necessariamente a todos os menores, pois pais, irmãos ou amigos que sejam maiores podem comprar para terceiros sem problemas. (assumindo que quem vai usar os produtos seja responsável o suficiente para saber os riscos envolvidos!)
3) Não considero 1kg de KOH e 1l de HNO3 (suficientes para obter mais de 1500g de KNO3), compráveis por menos de 20 reais, como "caro demais para valer a pena".
No mais, coloco-me a disposição para tirar quisquer dúvidas, e espero que você saiba avaliar melhor o que os outros escrevem, antes de criticar tão negativamente....
SDS
JEFCG
=====================================================
=====================================================
=====================================================
Eita!.. A discussão continuou e pegou fogo por lá..
Eu pessoalmente preferiria mil vezes mais o método "limpo" do anônimo n°2 do que o método do outro anônimo. Mas em todo caso, gastar HNO3 e KOH simplesmente para fazer nitrato de potássio, não é comigo.. Por isso eu ainda fico com o meu método de "inversão" do Salitre..
O resultado dessa discussão (assim como a lição que se pode tirar dela) , é que nenhum autor está mais certo do que outro , pois os dois usam métodos distintos... Não vale a pena brigar por discussões tão triviais.
REFERÊNCIAS:
- [1] Wikipédia
- [2] The Saltpeter Principle
- [3] Braifevert Page (Infelizmente as imagens sumiram, porém eu cheguei a vê-las e posso então dar testemunho aqui de que as imagens eram realmente reais e elucidativas)
- [4] Improvised Munitions Handbook
- [5] "O Nitro"
- [6] "Ad Astra"
- [7] INSTRUCTIONS FOR THE MANUFACTURE OF SALTPETRE
- [8] SYNTHETIC INORGANIC CHEMISTRY - A Course of Laboratory and Classroom Study For First Year College Students - A. B., ARTHUR ; W. P., JOSEPH ; R. D., ARTHUR. - 5ª Ed. John Wiley & Sons - 1936.
- [9] Obtaining KNO3
- [10] Solubilities of Inorganic and Organic Compounds - Atherton Seidell - D. Van Nostrand Company , Inc. - 2ªEd(2ª tiragem)(1919)
- [11] Frogfot's Page --> "Potassium Nitrate"
- [12] Inorganic Chemical Preparations - THORP, Frank Hall. - The Athnaeum Press, 1896.
- [13] Industrial Nitrogen Compounds And Explosives - MARTIN , G.; BARBOUR , W. - Crosby Lockwood and Son , 1915.
ATENÇÃO:
Essa página e suas páginas derivadas contém informações que podem ser perigosas. Além disso eu não garanto a total acuracidade ou precisão das referidas informações contidas nelas. As informações contidas em todas as páginas e sub-páginas derivadas e interconectadas dessa página são de caráter genuína e puramente educacional. Eu NÃO me responsabilizo por nenhum dano e/ou fatalidade a indivíduos, ou dano a propriedade decorrente do mal uso das informações aqui contidas, pelo fato de as informações aqui contidas serem de caráter puramente educacional. Basta um mínimo de raciocínio lógico para compreender : NÃO é justo que eu e outros eventuais colaboradores dessa página e de suas subseqüentes ,assim como qualquer outro autor normal, tenha algum tipo de responsabilidade por qualquer acidente que alguém sofra por realizar (ou tentar realizar) qualquer um dos experimentos descritos. Isso é facilmente explicado pelo fato de que eu não ordenei ninguém que fizesse nada descrito aqui e muito menos tenho a capacidade "divina" de ler e ver a mente e a vida de todas as pessoas para saber o que estão fazendo. Portanto, em toda e qualquer hipótese, eu NÃO admito ter o mínimo de responsabilidade , de qualquer ato praticado por qualquer pessoa antes e/ou durante e/ou depois de ler , parcialmente ou totalmente, qualquer uma de minhas páginas.
INÍCIO |
VOLTAR |
======================================
======================================
======================================
DIGA NÃO A CENSURA NA INTERNET!
SEJA CONTRA O "PROJETO" DO SR. EDUARDO AZEREDO QUE VAI RIDIDULARIZAR A NOSSA INTERNET E RESTRINGIR E FERIR AINDA MAIS NOSSA (JÁ DÉBIL) LIBERDADE, ASSIM COMO NOSSOS DIREITOS!
PRA RIR OU CHORAR?
