HALETOS DE ALQUILA /ARILA
1- Nomenclatura e exemplos
| Nomenclatura oficial IUPAC: | halogênio + hidrocarboneto |
| Nomenclatura usual: | ânion do halogênio + de + radical orgânico |
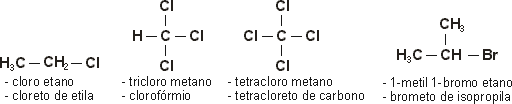
Alguns exemplos importantes:

3- Propriedades físicas
Em virtude da polaridade existente na ligação carbono-halogênio, os haletos possuem pontos de ebulição levemente mais elevados do que os alcanos de mesmo peso molecular. Apesar da polaridade, no entanto, os haletos não são solúveis em água, provavelmente por não terem possibilidade de formarem ligações de hidrogênio. Dissolvem-se apenas em solventes orgânicos. Os haletos mais simples, com até dois cerbonos na cadeia, são gases. À medida que a massa molecular aumenta, eles se tornam líquidos e, posteriormente, sólidos. Os haletos mais importantes são líquidos incolores de cheiro agradável, porém, tóxico. Apresentam pontos de ebulição próximos aos alcanos de mesma massa molecular.
O PE varia com o aumento da massa molecular do haleto, seja pelo aumento do radical orgânico, seja pelo aumento da massa do halogênio. Consequentemente, o PE aumenta ao passarmos dos fluoretos para cloretos, brometos e iodetos. Aumenta também passando de um mono para um di, tri etc e para um polihaleto. Os monofluoretos e os monocloretos são menos densos que a água; já os brometos e os iodetos são mais densos. Os polihaletos em geral são bastante densos. Em particular, o CH2I2 é o líquido de maior densidade (d = 3,32 g/ml). Ele é usado como "líquido de contraste" no estudo dos minerais ao microscópio.
4- Métodos de obtenção
A grande maioria dos haletos são sintetizados em laboratório para serem usados como ponto de partida para a obtenção de outros compostos orgânicos de maior interesse.
Veja aqui os principais métodos de obtenção dos haletos
5- Propriedades químicas
Os haletos de alquila são muito reativos e a partir deles pode-se obter praticamente todas as funções orgânicas. Isto torna-os importantíssimos nas sínteses orgânicas. Essa grande reatividade dos haletos é explicada pela forte polaridade da ligação entre o halogênio e o carbono, causando na cadeia um efeito indutivo -I. Já os haletos aromáticos são menos reativos, pois o efeito indutivo -I é contrabalanceado pelo efeito mesomérico +M, que aparece devido à ressonância de um par eletrônico livre do halogênio com o anel aromático. A reatividade dos haletos de alquila cresce da seguinte maneira: R-I > R-Br > R-Cl > R-F. Isso porque quanto maior o haleto, mais polarizável ele se torna, logo, reage com mais facilidade.
Veja aqui as principais reações dos haletos
6- Aplicações dos haletos
Em geral, os haletos são usados como:
Em particular, o cloro-etano é usado como:
Alguns haletos polifluorados são usados como:
Alguns haletos aromáticos policlorados são usados como:
Química 2000 - Wagner Xavier Rocha, 1999