PRINCIPAIS REAÇÕES DOS ALCENOS
1- Halidrificação
2-
Formação de haloidrina
3-
Halogenação
4-
Hidratação
5-
Reação com H2SO4
6-
Reação com perácidos
7-
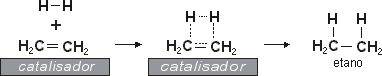
Hidrogenação
8-
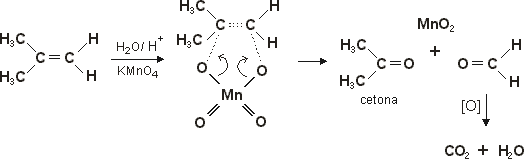
Oxidação por KMnO4
9-
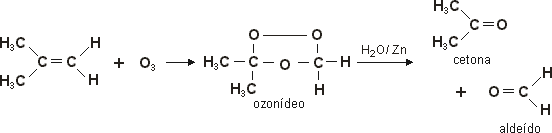
Ozonólise
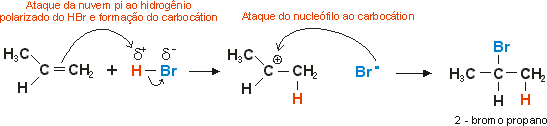
O HCl, o HBr e o HI transformam os alcenos nos correspondentes haletos de alquila. A reação consiste em fazer passar o haleto de hidrogênio, gasoso e anidro, diretamente através do alceno. Alcenos com mais de dois carbonos poderiam dar origem a mais de um produto. No entanto, na grande maioria dos casos, apenas um deles se forma ou existe um deles que se forma em maior quantidade em relação ao outro. A orientação da adição nos alcenos depende da estabilidade do carbocátion. Veja o exemplo abaixo:

Como se percebe, o carbocátion que se forma é secundário, e não primário. Entretanto, a orientação da adição do HBr, em especial, depende exclusivamente da presença ou ausência de peróxidos. Se a reação for feita em ausência de peróxidos orgânicos, a orientação da adição segue a regra de estabilidade dos carbocátions. Caso seja feita em presença de peróxidos, a orientação da adição se dá exatamente de modo oposto, ou seja, o H se liga ao carbono secundário e o Br no carbono primário. isso porque a reação nestas condições não se dá por meio iônico, e sim via radicais livres. O peróxido utilizado, frequentemente derivado de ácidos carboxílicos, inicia a reação por radical livre, e não há formação do carbocátion. Veja:
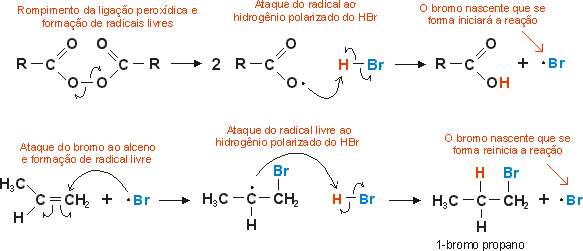
O motivo pelo qual o radical formado é secundário e não primário é o mesmo da estabilidade dos carbocátions: o efeito indutivo +I causado pelos grupamentos alquila para compensar e deficiência eletrônica no carbono.
Veja aqui alguns aspectos estereoquímicos da halidrificação de alcenos.
2- Formação de haloidrina (reação com H2O + Cl2)
Na adição de cloro ou bromo, em presença de água, podem formar-se compostos que possuem um halogênio e um grupo hidroxila em carbonos vicinais. Estes compostos denominam-se vulgarmente haloidrinas. Por escolha conveniente das condições da reação pode-se obtê-las como principais produtos. Veja:

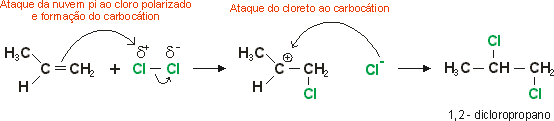
O cloro e o bromo transformam facilmente os alcenos em dihaletos vicinais, dissolvidos normalmente em um solvente inerte, como o tetracloreto de carbono. O iodo, em geral, não reage. A adição prossegue rapidamente, à temperatura ambiente ou inferior, constituindo a melhor maneira de se obter di-haletos vicinais. Sabemos que as moléculas de um halogênio qualquer é apolar, ou seja, não há diferença de eletronegatividade entre os átomos na molécula. Sabemos também que a adição em alcenos se dá pelo ataque dos elétrons pi a um eletrófilo. Neste caso, não há um eletrófilo com carga real. No entanto, as moléculas do halogênio criam um dipolo induzido pelo forte campo elétrico gerado pelas nuvens pi das moléculas do alceno que se encontram no meio. A densa nuvem eletrônica da dupla ligação tende a repelir a nuvem eletrônica do halogênio, fazendo com que o átomo de halogênio que estiver mais próximo da dupla seja relativamente mais positivo e o mais afastado relativamente negativo.
Veja aqui alguns aspectos estereoquímicos da halogenação de alcenos.
Em meio ácido, os alcenos reagem com a água formando álcoois:

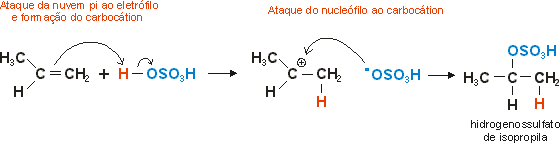
Os alcenos podem reagir com ácido sulfúrico concentrado a quente, originando sulfatos ácidos:
Pode-se tratar alcenos com perácido orgânico, resultando um processo de epoxidação, isto é, formação de um epóxido:

O epóxido formado pode ser tratado posteriormente hidratado em meio ácido ou básico, produzindo um glicol (diálcool vicinal):

Frequentemente utiliza-se a hidrogenação de alcenos para a produção de alcanos, isto é, quebra-se a dupla ligação, originando-se duas ligações simples. A adição de hidrogênio aos alcenos pode servir também como método de análise, para se determinar, por exemplo, o número de duplas ligações existentes no composto, através da verificação da quantidade de hidrogênio consumido na reação. A quantidade de calor liberado na hidrogenação de um mol de um composto insaturado chama-se calor de hidrogenação. Essa quantidade de calor em quase todos os alcenos gira em torno de 31 kcal por cada ligação dupla no composto. Os calores de hidrogenação podem também nos dar informações sobre as estabilidades relativas dos compostos insaturados.
Geralmente, quanto menor o calor liberado na hidrogenação, maior a estabilidade do composto. Por exemplo, o 2-buteno-cis libera 28,6 kcal/mol enquanto o isômero trans libera 27,6 kcal/mol. Isso significa que o isômero trans do 2-buteno é mais estável do que o cis. Também verificou-se que, quanto maior for o número de grupos alquilo ligados aos carbonos entre os quais existe a dupla ligação, mais estável será o alceno. Sendo a reação de hidrogenação exotérmica, não se dá, no entanto, mesmo a alta temperatura, se não estiver presente um catalisador. Este atua diminuindo a energia de ativação necessária para que a reação ocorra. Os reagentes são adsorvidos na sua superfície, rompendo as ligações pi e enfraquecendo as ligações sigma, o que facilita a reação. O paládio, a platina e o níquel podem servir como catalisadores da hidrogenação.
Os alcenos podem ser oxidados com permanganato de potássio em solução aquosa de duas maneiras: brandamente ou energicamente. As reações de oxidação e redução geralmente não apresentam um mecanismo bem explicado. Por isso não devemos nos preocupar muito com os detalhes destes processos.
Oxidação branda (Reação de Baeyer) - O permanganato em meio neutro ou levemente alcalino é oxidante brando, pois não chega a romper a dupla ligação, mas reage introduzindo oxigênios na cadeia. O permanganato é uma solução de coloração violeta intensa e quando ele passa para MnO2 precipita esse óxido marrom escuro. O resultado da oxidação branda de um alceno com KMnO4 é um diálcool vicinal (glicol). Como exemplo, vejamos a oxidação do propeno:

Oxidação enérgica - Em meio ácido o permanganato é oxidante bastante enérgico e leva à ruptura da dupla ligação, quebrando o alceno em moléculas menores. Os produtos formados na reação dependem do tipo de carbono da dupla ligação. Carbonos primários originam CO2 e H2O; carbonos secundários, ácidos carboxílicos, e carbonos terciários, cetonas. Vejamos o primeiro exemplo - a oxidação do buteno-2:

Perceba que o carbono da dupla na molécula inicial era secundário; daí a formação de ácidos carboxílicos.
O segundo exemplo é a oxidação do metil-propeno. Como os carbonos da dupla são terciário e primário, formam-se, respectivamente cetona e CO2 + H2O:
Os alcenos, reagindo com o ozônio em meio aquoso, produzem aldeídos e/ou cetonas. Trata-se de uma reação que destrói completamente a dupla ligação, quebrando a molécula do alceno em moléculas menores. O ozônio é um oxidante bastante enérgico e entra em reação de adição com o alceno, formando o ozonídeo ou ozoneto, um produto intermediário instável, que então se decompõe nos produtos finais, por hidrólise.
Na prática, faz-se borbulha o gás ozônio numa solução do alceno em solvente inerte, como o tetracloreto de carbono. Por evaporação do solvente em seguida, obtém-se o ozonídeo, que tem a forma de um óleo viscoso. Por ser muito instável e explosivo, não se pode purificar esse ozonídeo, e faz-se reagir diretamente com a água, geralmente em presença de um agente redutor. A função desse agente redutor, geralmente a limalha de zinco, consiste em impedir a formação do peróxido de hidrogênio, que se aparecesse, reagiria com aldeídos e cetonas. O zinco captura um oxigênio, formando o óxido de zinco (ZnO). Veja o exemplo da ozonólise do metil propeno:
Química 2000 - Wagner Xavier Rocha, 1999