Desencontros Genéticos da Doença de Huntington
Helena Cattaneo, Dorotea Rigamonti e Chiara Zuccato
(extraído da revista Scientific American Brasil, janeiro/2003)
Quase 10 anos após isolarem o gene responsável pela doença de Huntington, cientistas ainda pesquisam como ela se manifesta. A tragédia da doença de Huntington é que ela aparece na fase adulta, causando movimentos involuntários, similares à dança, comprometimento mental e angústia - portanto, privando o paciente de sua vida normal. A raiz da desordem é uma extensa repetição da seqüência de DNA citosina-adenina-guanina (CAG).
Mímicas faciais incomuns são o primeiro sinal de que alguma coisa está errada. Depois, as pessoas afetadas mostram-se cada vez mais desatentas e começam a apresentar gesticulação involuntária, principalmente sob estresse físico ou psicológico. À medida que a doença progride, movimentos que podem ser confundidos com embriaguez tornam-se mais freqüentes e incapacitantes. As pessoas perdem a habilidade de realizar tarefas simples, cotidianas, e demonstram prejuízo em atividades intelectuais, como o planejamento. Em estágios mais avançados, aparecem depressão e agressividade - e, em casos mais graves, demência e psicose.
Este é o triste quadro da doença de Huntington, uma desordem hereditária que atinge comumente pessoas com predisposição genética, na fase adulta, entre os 30 e 40 anos. Como não existe um tratamento efetivo, a doença avança devagar, mas inexoravelmente, levando geralmente à invalidez total e morte após 15 ou 20 anos. Apesar de a doença de Huntington afetar principalmente o sistema nervoso central (SNC), a maior parte dos doentes morre mais tarde de complicações cardíacas ou respiratórias, resultantes de confinamento ao leito.
O gene que causa a doença foi identificado em 1993 por uma coalizão de 50 cientistas em todo mundo, incluindo James F. Gusella, do Hospital Geral de Massachusetts, em Charlestown, e Francis Collins, que estava, na época, na University of Michigan, em Ann Arbor. Logo a seguir, foram desenvolvidos testes genéticos, que permitiram aos familiares dos portadores da doença determinar se haviam herdado o gene mutante. Sendo um gene dominante, os que herdam a forma mutante estão fadados a manifestar a doença e têm 50% de chance de passar o gene para cada filho.
Tentando oferecer esperança a famílias com a Huntington, cientistas como nós estão trabalhando para compreender melhor como o gene mutante causa a doença e como seria possível inibi-lo ou fazer o tratamento. Encontramos evidências de que a mutação que permeia a doença tem duplo sentido: ela não só contém uma proteína anormal que aparenta ser tóxica às células nervosas, como essa proteína defeituosa não consegue mais induzir a produção de um fator de crescimento essencial, levando à morte neurônios restritos a uma região do cérebro. Estudos iniciais realizados com animais - e testes clínicos envolvendo humanos - sugerem que terapias com fatores de crescimento poderiam conter esses efeitos. Descobertas mais recentes, porém, explicam parcialmente a patologia Huntington, sendo necessária uma pesquisa contínua para esclarecer suas complexidades.
De Huntington à huntingtina
A doença de Huntington leva o nome de George Huntington, um médico de Ohio. Em 1872, Huntington relatou amplamente uma doença hereditária peculiar que tanto ele quanto seu pai, também médico, haviam observado em uma família de Long Island, New York. Notando os movimentos estranhos e descoordenados dos pacientes, ele denominou a doença de "chorea" (coréia), derivada da palavra grega choros, significando "dança". Hoje os médicos reconhecem a Huntington como uma das doenças hereditárias mais comuns que afetam o SNC, vitimando aproximadamente uma pessoa em cada 10 mil.
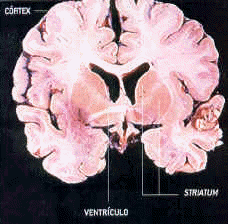
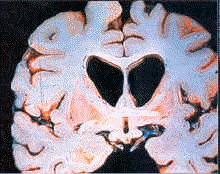
Os sintomas da doença são causados pela degeneração das células, ou neurônios, localizados no striatum, uma região bem interna do cérebro, que é parte de uma estrutura denominada gânglios da base (ver ilustração abaixo). Esses neurônios trabalham normalmente no sentido de inibir os sinais excitatórios provenientes do córtex motor, a parte do cérebro que comanda os movimentos. Quando eles morrem, o córtex motor se toma hiperativo, causando movimentos involuntários (também conhecido como coréia). Ainda menos esclarecida é como a morte dos neurônios estriatais causa os sintomas de desordem psicológica.
O gene que sofre a mutação na Huntington, cognominado huntingtina, fica numa extremidade do cromossomo 4. Os genes são segmentos da dupla hélice do DNA que codificam a informação para a fabricação de proteínas. O código consiste na combinação de quatro unidades simples, as bases, denominadas: adenina (A), timina (T), citosina (C) e guanina (G). As bases se emparelham umas às outras para formar os degraus da escada helicoidal do DNA. A base A faz par com T, e C faz par com G. Quando a célula necessita produzir novas proteínas, a hélice se distorce e os degraus se rompem para que o mecanismo celular possa ler o código. Um grupo de três bases codifica um dos 20 aminoácidos que são colocados juntos em várias combinações e que geram milhões de proteínas distintas em todo o corpo.
Quando pesquisadores detectaram o gene huntingrina, observaram que ele contém, mesmo em pessoas normais, um tipo de repetição molecular, em que o trio CAG se repete entre nove e 35 vezes. (Essas repetições prolongadas podem ocorrer também em genes diferentes e estão associadas a doenças degenerativas como a distrofia miotônica.) Nos portadores da doença de Huntington, porém, a repetição se toma especialmente prolongada, estendendo-se até 250 repetições. Cientistas constataram, curiosamente, que pessoas com maiores repetições de CAG tendem a desenvolver a doença com menos idade que aquelas com uma repetição mais curta. E, por razões desconhecidas, o número de repetições de CAG pode aumentar de geração para geração em famílias com a doença de Huntington; isso aparentemente acontece com maior freqüência quando o gene mutante é herdado do pai.
As teorias
O trio CAG codifica para o aminoácido glutamina, designado pela letra Q. Os portadores da forma mutante do gene huntingtina possuem proteínas huntingtínicas que contêm partes da chamada poliglutamina, consistindo em 36 ou mais Qs. Mas por que as glutaminas extras em uma proteína de veriam causar doença?
A explicação mais simples é que uma longa cadeia de poliglutaminas destrói a habilidade das proteínas da huntingtina de realizar seu trabalho habitual no cérebro. Essa hipótese da "perda de função" foi inicialmente descartada, porque estudos mais antigos mostraram que a huntingtina é produzida não só no striatum, a região que se mostra retraída como resposta à doença, mas também em outras regiões do cérebro que, aparentemente, não são afetadas durante o curso da doença de Huntington. Além disso, os humanos possuem duas cópias de cada gene - uma por parte da mãe e outra do pai - portanto, as pessoas com Huntington deveriam ainda dispor de uma cópia boa da huntingtina, e assim produzir uma quantidade razoável de proteína saudável.
Uma hipótese alternativa, "ganho de função", considera que a mutação da huntingtina produz uma forma tóxica da proteína huntingtina. Segundo essa visão, a longa cadeia poliglutamínica resultante da mutação da huntingtina modifica o formato da proteína mutante, permitindo que ela se cole a muitas outras proteínas - particularmente huntingtinas normais, que ela inibe. A ligação poderia explicar por que a doença é herdada de um padrão dominante. Todavia, ainda continua sendo largamente debatido como os agregados de huntingtina mutante causam o dano neural. Uma hipótese é que os proteosomas - estruturas celulares que destroem proteínas tóxicas ou usadas - não conseguem destruir as proteínas da huntingtina mutante, por sua conformação aberrante. Como resultado, a huntingtina mutada acumula células descontroladas, que induzem morte neural. A hipótese "ganho de função", porém, não pode facilmente explicar por que outras regiões do cérebro, além do striatum, não são afetadas.
Outras hipóteses sugerem que, ao invés de serem responsáveis pela doença, os agregados poderiam representar um mecanismo de defesa que protegeria as células dos efeitos tóxicos da poliglutamina. Estudar o papel desses agregados toma-se crucial para a compreensão da doença de Huntington, e para encontrar formas de inibi-los ou destruí-los, o que poderia conduzir a novas drogas para a doença.
Outra linha de pesquisa baseia-se na identificação de moléculas que são especificamente expressas no striatum e que podem interagir com as huntingtinas. Se tais moléculas ficarem presas aos agregados, elas podem contribuir para a toxicidade. Pesquisadores conseguiram até agora identificar três grupos de proteínas que interagem com a huntingtina, mas nenhuma parece explicar a natureza tóxica da huntingtina mutada, ou explicar por que só os neurônios estriatais morrem na doença de Huntington.
Uma proteína salva-vidas
Para resolver esse quebra-cabeça, nós e outros pesquisa dores - incluindo Scott Zeitlin da Columbia University - procuramos determinar a função da huntingtina normal no cérebro. Começamos examinando os efeitos do uso de engenharia genética, para inserir tanto cópias extras de huntingtina normais como formas mutantes do gene dentro de neurônios desenvolvidos em laboratório. Em 2000, constatamos que as células que superproduzem huntingtinas normais podem resistir, quando privadas do meio de crescimento, ou sob outras condições que poderiam levar à morte. Além disso, descobrimos que a huntingtina normal parece manter os neurônios vivos por deter a cascata de eventos moleculares que geralmente conduz à apoptose, que é a morte programada das células. Concluímos que a huntingtina normal funciona como uma proteína salva-vidas para os neurônios.
Zeitlin e colegas ampliaram essas descobertas através da geração de camundongos com o denominado knockout (ausência do gene), em que ambas as cópias do gene huntingtina podem ser desligadas quando os animais estiverem desenvolvidos. No momento em que o gene é desativado, o camundongo pára de produzir a proteína huntingtina e desenvolve um grave dano no SNC.
O grupo de Zeitlin também demonstrou que a interrupção da produção de huntingtina em diversos estágios da vida do rato resulta na morte de neurônios por apoptose. Além disso, os pesquisadores mostraram que o rato que não possui a forma normal da huntingtina apresenta sintomas neurológicos similares aos ratos que expressam a forma mutante da proteína. Essa observação sugere que a falta da huntingtina normal e a presença da huntingtina mutante poderiam ser faces diferentes da mesma moeda.
O estudo em ratos, porém, não explica por que os neurônios estriatais são o alvo preferido na Huntington. Para desvendar esse mistério, nós e outros nos voltamos para estudar o fator neurotrófico derivado do cérebro (BDNF), um fator de crescimento conhecido por ser crucial para o desenvolvimento e a sobrevivência dos neurônios no striatum. O BDNF é tipicamente produzido nos corpos celulares dos neurônios do córtex, e depois viaja ao stríatum pelas fibras que ligam as duas regiões cerebrais.
Curiosamente, descobrimos que a huntingtina normal estimula a produção de BDNF em neurônios produzidos em culturas de laboratório. Especificamente, a huntingtina parece acionar o botão “ligar", ou promotor, do gene que codifica o BDNF. Isso ativa o gene BDNF, que induz a produção de mais fator de crescimento pelos neurônios. Além disso, a huntingtina mutante não estimula o promotor BDNF, resultando em menor produção do BDNF. Confirmamos, também, a ligação entre a huntingtina e o BDNF em experimentos envolvendo ratos geneticamente manipulados por Michael Hayden e seus colegas da University of British Columbia. Descobrimos que esses ratos, com produção amplamente expressa de huntingtina normal, apresentam uma quantidade elevada de BDNF no cérebro, o que não acontece com os ratos com huntingtina mutante.
Baseados nessa informação, nós entendemos, agora, que a doença de Huntington é uma desordem complexa, que não se ajusta com precisão à nossa antiga hipótese. A mutação da doença não só produz agregados tóxicos, que podem diretamente matar os neurônios, mas também priva o cérebro da huntingtina normal - que poderia, por outro lado, acionar o gene para o fator de crescimento BDNF. Esses dois aspectos podem, realmente, estar relacionados.
Salvar o cérebro?
Munidos de uma melhor compreensão sobre as complexidades da doença de Huntington, podemos, agora, nos voltar para a busca de tratamentos. As drogas atualmente disponíveis somente aliviam alguns dos sintomas e podem apresentar graves efeitos colaterais, melhorando um sintoma para fazer com que outro se acirre. Apesar de os médicos comumente receitarem sedativos aos portadores da Huntington, para controlar os movimentos involuntários, essas drogas também diminuem os níveis do neurotransmissor dopamina no cérebro, piorando os sintomas depressivos.
Antidepressivos causam alívio, mas alguns tipos podem exacerbar a coréia. Os médicos utilizam substâncias conhecidas como neurolépticas para tratar pacientes com alucinações e psicose, mas as dosagens devem ser mantidas baixas, porque elas podem, também, induzir movimentos convulsivos.
Tentativas mais inovadoras para o tratamento da doença de Huntington visam repor os neurônios deteriorados com trans plante de tecido fetal, injeção ou infusão de fatores neurotróficos como o BDNF. A primeira tentativa revelou resultados encorajadores, apesar de preliminares, em pacientes nos primeiros estágios da doença. Mas esse uso permanece controvertido à luz das questões éticas envolvendo tecido derivado de fetos abortados. Marc Peschanski e colaboradores da Escola de Medicina em Creteil, França, por exemplo, transplantaram neurônios fetais no striatum de cinco pacientes com a doença de Huntington e três apresentaram uma considerável melhora nas funções motoras e intelectuais. Pesquisadores estão agora tentando produzir células neurais em laboratório, para utilizá-las em transplantes e superar a disponibilidade limitada de células fetais, e a controvérsia que as cerca. Mas ainda é uma questão em aberto se a huntingtina mutante, produzida pelos outros neurônios do paciente, irá romper a huntingtina normal, produzida pelas células enxertadas. Por essa e por outras razões, o potencial terapêutico do tecido fetal para a doença de Huntington permanece incerto.
A segunda tentativa baseia-se em estudos com animais, mostrando que o fator neurotrófico ciliar (CNTF) pode proteger as células estriatais da morte. Tem sido difícil, porém, liberar o fator de crescimento no cérebro em quantidade suficiente e de forma ativa. Proteínas como as BDNF e CNTF são transformadas no estômago quando ministradas oralmente; quando aplicadas por injeção ou infusão, às vezes não conseguem atravessar a barreira hematoencefálica, que protege o cérebro de substâncias que circulam no sangue.
Patrick Aebischer, da Escola Médica da Universidade de Lausanne, na Suíça, elaborou um protocolo para terapia genética, em que ele e seus colaboradores implantam cápsulas semiper meáveis, contendo células geneticamente modificadas, para liberar CNTF no ventrículo direito do cérebro. Ao descobrir, em chimpanzés, que as cápsulas liberam CNTF continuamente, o grupo de Aebischer juntou-se ao grupo de Peschanski para avaliar a estratégia em um pequeno número de pacientes. O CNTF tem sido testado em pessoas antes do BDNF, porque o efeito protetor sobre as células estriatais foi descoberto vários anos antes de se conhecer os benefícios do BDNF.
Diversos grupos de pesquisa estão agora planejando testar o BDNF em pacientes com doença de Huntington. O promotor BDNF poderia também oferecer um alvo para o desenvolvimento de drogas contra a Huntington. Substâncias que imitam a função natural da huntingtina na síntese do gene BDNF poderiam deter a mutação huntingtina. Como essas drogas poderiam agir em seqüência de eventos da proteína huntingtina, não importaria se a huntingtina normal do paciente ficasse aderida a um agregado com a forma mutante da proteína. Na verdade, podemos prever que o futuro da terapia farmacológica para a doença de Huntington encontra-se nos medicamentos que podem interferir na toxicidade da huntingtina mutante, enquanto recupera os efeitos benéficos da huntingtina normal. Se pudermos desenrolar o fio de mistérios que cerca a doença de Huntington, talvez possamos oferecer esperança à próxima geração.
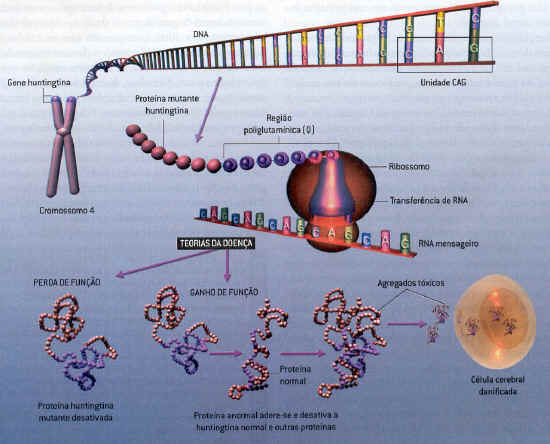
Base molecular da doença de Huntington
Várias teorias podem explicar como a doença de Huntington manifesta-se. O gene responsável pela desordem - chamado huntingtina encontra-se numa extremidade do cromossomo quatro. Normalmente o gene contém entre nove e 35 repetições da seqüência de DNA citosina. adenina-guanina (CAG). Mas, em famílias com a doença, o gene normalmente tem entre 40 e 60 repetições. Quando o gene huntingtina está ativo, a seqüência de DNA é transcrita para o RNA mensageiro, que dirige o maquinário de fabricação de proteína da célula - transfere RNA e ribossomos - para fazer proteína huntingtínica. montando a seqüência apropriada de aminoácidos. Como o CAG codifica o aminoácido glutamina (que os cientistas denotam pela letra Q), a huntingtina mutante contém uma ampla região de poliglutamina. Essa região pode causar a doença, desabilitando a proteína huntingtina (teoria da perda de função), ou permitindo que ela se cole e iniba a proteína normal huntingtina ou outras proteínas (teoria do ganho de função). Tais agregados de proteína parecem ser tóxicos às células cerebrais. A mutação de Huntington também pode causar a doença através de uma combinação destes mecanismos.
Resumo
• A doença de Huntington - que incapacita e causa demência em pessoas na fase adulta - é uma desordem genética que resulta da mutação de um gene denominado huntingtina, encontrado no cromossomo quatro.
• Existem testes genéticos para a doença, mas não há cura.
• Pessoas predispostas a desenvolver a doença apresentam uma repetição molecular na huntingtina, que sintetiza uma forma mutante da proteína huntingtina, onde o mesmo aminoácido, a glutamina, se repete dezenas de vezes.
• A huntingtina mutante parece ser tóxica a importantes células nervosas do SNC. Ela também perde a habilidade de sintetizar um gene necessário para o fator de crescimento.
Para conhecer mais
• A Novel Gene Containing a Trinucleotide Repeat That Is Expanded and Unstable on Huntington's Disease Chromosomes. The Huntington's Disease Collaborative Research Group in Cell, Vol. 72, páginas 971-983, março 26, 1993.
• Loss of Normal Huntingtin Function: New Developments in Huntington's Disease Research. Elena Cattaneo, Dorotea Rigamonti, Donato Goffredo, Chiara Zuccato, Ferdinando Squitieri and Simonetta. Sipione in Trends in Neurosciences, Vol. 24, páginas 182-188, março 2001.
• Loss of Huntingtin-Mediated BDNF Gene Transcription in Huntington's Disease, Chiara Zuccato et al. in Science, Vol. 293, páginas 493-498, julho 20, 2001.
• Huntington's Disease Society of America, www.hdsa.org
• Hereditary Disease Foundation, www.hdf.org
As autoras
Elena Cattaneo, Dorotea Rigamonti e Chiara Zuccato são do departamento de ciências farmacológicas no Centro de Excelência em Doenças Neurodegenerativas da Universidade de Milão, Itália, onde Cattaneo é professora de biotecnologia farmacêutica. A pesquisa de Cattaneo também envolve o estudo de células tronco e seu uso no tratamento de doenças neurodegenerativas como a doença de Huntington. Desde 1995, ela colabora com a "Coalizão para a cura", um consórcio internacional de pesquisa promovido pela Sociedade Americana da Doença de Huntington, e para a Iniciativa de Cura DH, mantida pela Fundação de Doença Hereditária. Ela tem sido, desde 1988, uma investigadora da Fundação Italiana Telethon. Entre seus prêmios e títulos está uma medalha recebida do presidente da Itália, Carlo Azeglio Ciampi, por seu trabalho com células-tronco e com a doença de Huntington. Rigamonti e Zuccato são associadas, com pós-doutorado no laboratório de Cattaneo. Ambas receberam seus Ph.Ds em 2000: Rigamonti pela Universidade de Milão e Zuccato pela Universidade de Insubria, Varese.