EQUILÍBRIO DE DONNAN
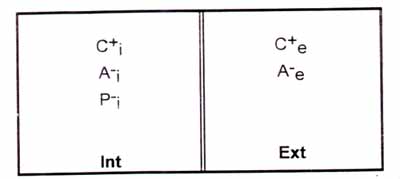
Entre a célula e o meio ambiente podemos distinguir dois compartimentos separados por uma membrana (membrana plasmática): o meio intracelular e o meio extracelular. Embora a membrana plasmática seja permeável a diversos íons, o meio intracelular contém substâncias tais como proteínas, ácidos nucléicos, ésteres e outras, que em pH fisiológico têm carga resultante negativa e não conseguem atravessá-la.
A análise do comportamento de um sistema deste tipo leva ao chamado Equilíbrio de Donnan, com características diferentes do estado de equilíbrio atingido por uma membrana permeável a um único Íon ou a todos os íons, como descrito nos casos anteriores.
Assim, este sistema. após ter alcançado o equilíbrio, encontra-se na seguinte situação:

[Cj) = concentração de cátion difusível no compartimento interno
[Ce] = concentração de cátion difusível no compartimento externo
[Aj] = concentração de ânion difusível no compartimento interno
[Ae] = concentração de ânion difusível no compartimento externo
[Pj] = concentração de ânion não difusível no compartimento interno
Trata-se de um sistema fechado com paredes rígidas, que apresentará as seguintes características:
Eletroneutralidade:
número de cargas positivas = número de cargas negativas
Pj + Aj = Cj, no compartimento interno.
Ae = Ce, no compartimento externo.
Equilíbrio eletroquímico de todos os íons difusíveis:
Quando o sistema atinge o equilíbrio, o potencial eletroquímico deve ser igual, nos dois compartimentos, para cada um dos íons difusíveis (qualquer estado de equilíbrio é sempre caracterizado por Aμ=0, Jres=0) . Isto significa que a equação de Nernst pode se aplicada para cada íon difusível do sistema.
Para os cátions difusíveis (Z=+1):
R . T Ce
Ψj - Ψe = ------- In ----
F Cj
E para os ânions difusíveis (Z=-1):
R . T Aj
Ψj - Ψe = ------- In ----
F Ae
Como no equilíbrio:
R . T Ce R . T Aj
------- In ---- = ------- In ----
F Cj F Ae
Conclui-se que:
CjAj = CeAe
Assim, no estado de equilíbrio estabelece-se uma diferença de potencial elétrico através da membrana, tal que o compartimento que contém o ânion não difusível é eletronegativo em relação ao outro (polarização elétrica da membrana).
Considerando apenas o Na+, o K+ e o CI- dentre os íons difusíveis presentes nos meios extra e intracelular:
[Na]e [K]e [Cl]j
------- = ------- = -------
[Na]j [K]j [Cl]e
Desequilíbrio Osmonótico:
Esta é outra conseqüência do equilíbrio de Donnan. Quando ele é atingido, a concentração iônica total (cátions e ânions) no compartimento que contém o ânion não difusível é maior que a concentração de íons no outro compartimento. Isto origina uma diferença de pressão osmótica entre os dois compartimentos, de sérias conseqüências para a vida.
Esta distribuição, no entanto, ocorre apenas em células submetidas á inibição metabólica prolongada.
Na célula viva normal, na presença do fornecimento adequado de ATP, tal distribuição iônica é profundamente alterada. Assim, por exemplo:
A relação de concentração interna/externa para o sódio é de 1/12 e para o potássio é de 39/1
Esta diferença de distribuição não vai contra o princípio da eletro-neutralidade pois no interior celular as cargas positivas do K+ estão compensando as cargas aniônicas não difusíveis através da membrana celular (proteinatos).
A pressão osmótica gerada por estes proteinatos não difusíveis deve então ser compensada nestas células por algum soluto impermeante do lado extracelular que, no caso, é o Na+. O mecanismo responsável pela manutenção do íon Na+ praticamente impermeante do lado extracelular é o transporte ativo.
Nesta situação estacionária, a intensidade da ΔΨ que se estabeleceria através da membrana dependeria das permeabilidades relativas dos ânions e cátions permeantes, sendo dada pela equação de Goldman, Hndgkin e katz (GHK):
R.T PNa[NA]1 + PCl[CL]2
Ψ2 – Ψ1 = ----- In ---------------------
F PNa[Na]2 + PCl[Cl]1
PRÓXIMO TEXTO: Potencial de repouso