Clique aqui para fechar esta janela Voltar a página anterior
| TERMODINÂMICA |
INTRODUÇÃO
As máquinas térmicas são sistemas termodinâmicos que trocam calor e trabalho com o meio externo. Algumas delas, como os motores de automóveis, recebem calor de uma fonte quente, e uma parte desse calor é convertida em trabalho mecânico. Por outro lado, os refrigeradores retiram calor de uma fonte fria (congelador) e, às custas de um trabalho mecânico realizado pelo compressor, transferem-no para o meio externo.
Nesse estudo, vamos analisar as leis que regem essas conversões e do funcionamento dessas máquinas. Iniciaremos com a idéia de trabalho em sistema termodinâmico
TRABALHO EM TERMODINÂMICA
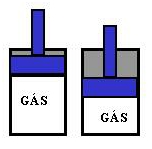
Consideremos um gás contido num cilindro provido de êmbolo (ou pistão)
Ao se expandir, o gás exerce uma força no êmbolo, que se desloca no sentido da força. Observe que o trabalho realizado pelo gás deslocando o êmbolo, faz o volume do gás aumentar, sendo assim o trabalho será considerado positivo.
 |
Ao ser comprimido, o gás sofre a ação de uma força exercida pelo êmbolo. Observe que o trabalho realizado sobre o gás, faz o seu volume diminuir, sendo assim o trabalho será considerado negativo.
 |
O trabalho realizado pelo gás ou sobre o gás, será calculado através da seguinte expressão:
 |
t ( tau ) ... Medido em joules ( S.I ) ou cal.
P ... Pressão do gás medida em N / m2 ( S.I ).
V ... Volume final do gás, medido em m3 ( S.I ).
Vo ... Volume inicial do gás, medido em m3
ATENÇÃO NAS SEGUINTES UNIDADES:
|
1 m3 = 1000 litros = 106 cm3 = 103 dm3 |
|
105 N/m2 = 105 Pa = 1 atm = 760 mm Hg |
|
1 m3 = 1 m x 1 m x 1 m 1 m3 = 100 cm x 100 cm x 100 cm 1 m3 = 106 cm3 |
|
1 cal = 4,18 joules |
![]() Pa = Pascal (S.I)
Pa = Pascal (S.I)
ENERGIA INTERNA DE UM GÁS
A energia interna de um gás perfeito é a soma das energias cinéticas médias de todas as suas moléculas.
A energia interna de um gás perfeito está diretamente associada à sua temperatura.
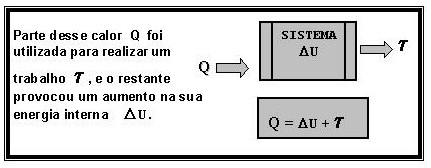
Quando um sistema (gás) recebe uma determinada quantidade Q de calor, sofre um aumento D U de sua energia interna e consequentemente um aumento de temperatura D t . Assim...
|
|
PRIMEIRO PRINCÍPIO DA TERMODINÂMICA
De acordo com o Princípio da Conservação da Energia, a energia não pode ser criada nem destruída, mas somente transformada de uma espécie para outra. O Primeiro Princípio da Termodinâmica estabelece uma equivalência entre o trabalho e o calor, trocados entre um sistema e o seu exterior.
 |
 |
BALANÇO ENERGÉTICO
Para aplicar o primeiro princípio, que envolve as grandezas calor, trabalho e energia cinética, é preciso fazer um balanço energético, isto é, saber quando essas grandezas assumem valores positivo, negativos ou nulos.
Temos as seguintes possibilidades:
|
GÁS (Sistema)
|
|
GÁS (Sistema)
transformação isométrica )
|
|
GÁS (Sistema)
|
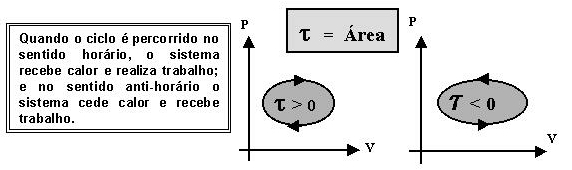
TRANSFORMAÇÃO CÍCLICA
Transformação Cíclica ou ciclo de um sistema é o conjunto de transformações sofridas pelo sistema de tal forma que os seus estados final e inicial são iguais.
Como a temperatura final é igual à temperatura inicial, a energia interna do sistema não varia ( D U = 0 ), havendo uma igualdade entre o calor e o trabalho trocados em cada ciclo.
Num diagrama P x V, uma transformação cíclica é representada por uma curva fechada . A área interna do ciclo é numericamente igual ao trabalho total trocado com o meio exterior .
 |
SEGUNDO PRINCÍPIO DA TERMODINÂMICA
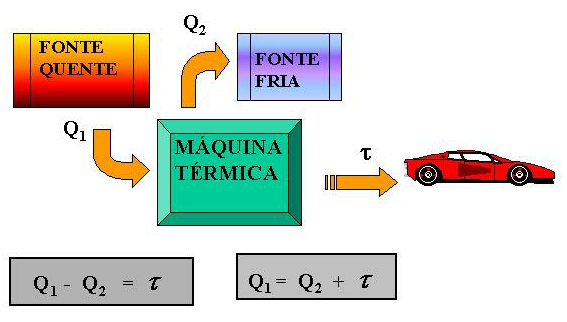
O segundo princípio da Termodinâmica estabelece as condições em que é possível à transformação de calor em trabalho, completando, dessa forma, o primeiro princípio, que trata apenas da equivalência entre o calor e o trabalho.
A conversão de calor em energia mecânica é conseguida por meio de uma máquina térmica. Como exemplo de máquina térmica podemos citar as turbinas a vapor, as turbinas a querosene que impulsionam os aviões a jato, os motores de explosão que queimam gasolina, álcool ou diesel, ou mesmo um reator termonuclear de uma usina atômica.
 |
|
em trabalho. |
RENDIMENTO DE UMA MÁQUINA TÉRMICA ( h )
O rendimento de uma máquina térmico ( h ) é definido como a razão entre o trabalho que dela pode ser aproveitado e a quantidade de calor recebido da fonte quente.
Como nem todo o calor retirado da fonte quente é transformado em trabalho, o rendimento de uma máquina térmica nunca pode ser 100% ( h = 1 ); daí o enunciado de Kelvin e Planck para o segundo princípio da Termodinâmica.
| "É
impossível construir uma máquina térmica que operando em ciclos,
transforme em trabalho todo o calor recebido de uma fonte". |
 |