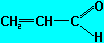1. O carbono é tetravalente (faz quatro ligações simples);
2. As ligações do carbono são equivalentes e coplanares (são iguais e ocupam o mesmo plano do espaço);
 3. Átomos de carbono podem ligar entre si formando cadeias.
3. Átomos de carbono podem ligar entre si formando cadeias.Como dito anteriormente, os compostos orgânicos sempre contém carbono, por isso é muito importante o conhecermos melhor.
Durante o século XIX o problema não era saber a composição dos compostos, mas saber como os átomos se uniam. Surgiu então o postulado de Kekulé, que dizia:
1. O carbono é tetravalente (faz quatro ligações simples);
2. As ligações do carbono são equivalentes e coplanares (são iguais e ocupam o mesmo plano do espaço);
 3. Átomos de carbono podem ligar entre si formando cadeias.
3. Átomos de carbono podem ligar entre si formando cadeias.
A teoria de Kekulé dizia que a estrutura do carbono era plana, mas com o avanço da química orgânica percebeu-se que essa estrutura não explicava algumas das observações verificadas em algumas das novas substâncias.
Em 1874, Van't Hoff e Le Bel criaram um novo modelo para a estrutura espacial das ligações do carbono. Este novo modelo propunha uma estrutura em forma de tetraedros regulares, onde o núcleo do átomo de carbono ocuparia posição central, e suas ligações nos vértices.
Assim, se houvesse uma ligação simples os tetraedros se uniriam pelos vértices. Em uma ligação dupla os tetraedros se ligariam por dois vértices (uma aresta) e em uma ligação tripla eles se ligariam por três vértices (uma face). Esse modelo explica muito bem por que o carbono não faz uma ligação quádrupla: por falta de espaço.
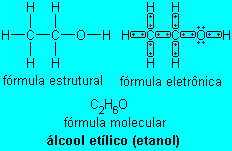
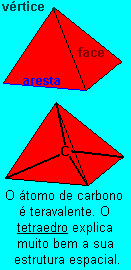
Quando esse modelo foi criado ainda não se conheciam os elétrons, sendo que, depois de criado o atual modelo atômico de Rutherford-Böhr, Lewis propôs que os átomos se ligassem através de pares eletrônicos na camada de valência. Tal representeção é conhecida por Fórmula Eletrônica de Lewis:
Após criado esse modelo houve algumas mudanças na ligação covalente e foi desenvolvida a teoria da hibridação.
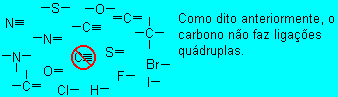
Não é só o carbono que participa dos compostos orgânicos. Quase sempre existe existe também hidrogênio (monovalente), oxigênio (bivalente) e outros. Os mais frequentes são: enxofre (bivalente), nitrogênio (trivalente) e halogênios (monovalentes).
É muito importante conhecer também as cadeias formadas por átomos de carbono. Veja um exemplo:

Veja que um átomo de oxigênio está em destaque. Outros átomos também podem estar na cadeia carbônica, com a condição que esteja entre dois átomos de carbono. Tal átomo é denominado de heteroátomo.
Cadeia carbônica é a estrutura formada por todos os átomos de carbono e heteroátomos de uma molécula orgânica |
Pode-se representar os compostos orgânicos de uma forma mais simplificada:

Classificação das cadeias carbônicas
As cadeias são classificadas da seguinte maneira:

A glicerina tem cadeia carbonica com extemos livres. É uma cadeia carbônica aberta (acíclica ou alifática). já o ciclobuteno não apresente extremos livres: Tem cadeia carbônica fechada (ou cíclica).
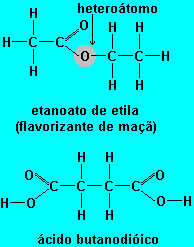
O etanoato de etila tem cadeia carbônica heterogênea pois existe um átomo de oxigênio entre dois carbonos (heteroátomo).
Enquanto o ácido butanodióico tem cadeia carbônica homogênea, pois há apenas átomos de carbono (lembrando que os quatro átomos de oxigênio dessa molécula não são heteroátomos, pois não estão entre dois carbonos).
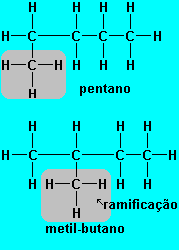
A molécula de pentano é normal (ou não-ramificada), pois, em cadeias abertas, tem apenas dois extremos. A parte destacada não é ramificação, pois não existe ramificação no final da cadeia.
O metil-butano no entanto tem cadeia carbônica ramificada, pois apresenta mais de dois extremos.
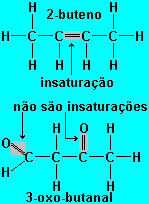
Se existir uma ou mais ligações duplas ou triplas entre carbonos a cadeia será classificada como insaturada, sendo q esta dupla será chamada de insaturação.
Insaturação é uma ligação dupla ou tripla entre átomos de carbono. |
Portanto o 2-buteno tem cadeia carbônica insaturada
Já o 3-oxo-butanal tem cadeia saturada. Vale lembrar que as duplas ligações destacadas não são insaturações, pois não estão entre carbonos.
Também pode-se classificar as cadeias carbônicas fechadas em aromáticas ou não-aromática. Uma cadeia aromática contém anel benzênico.
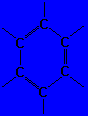 Anel benzênico é uma estrutura cíclica que contém seis átomos de carbono com duplas e triplas intercaladas. |
Devido o efeito da ressonância a representação mais usada para representar o anel benzênico é: 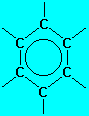 |
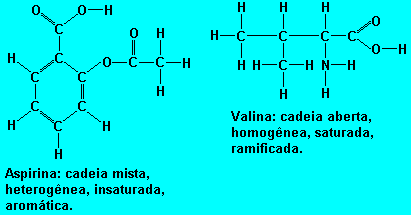
Então podemos classificar as cadeias carbônicas a seguir como:
Para facilitar a comunicação entre os químicos a IUPAC(União Internacional da Química Pura e Aplicada) criou regras que facilitam a nomenclatura das substâncias.
| Número de carbonos | Prefixo |
| 1 | met |
| 2 | et |
| 3 | prop |
| 4 | but |
| 5 | pent |
| 6 | hex |
| 7 | hept |
| 8 | oct |
| 9 | non |
| 10 | dec |
| 11 | undec |
| 12 | dodec |
| Tipos de ligações | Intermediário |
| apenas simples | an |
| uma dupla | en |
| duas duplas | dien |
| uma tripla | in |
| duas triplas | diin |
| uma dupla e uma tripla | enin |
| Função | Sufixo |
| hidrocarboneto | o |
| álcool | ol |
| aldeído | al |
| cetona | ona |
| ácido carboxílico | óico |
Essas tabelas são necessárias para formular a nomenclatura dos compostos orgânicos, mas muitas vezes usam-se outros artifícios. Por exemplo: a função ester não está na terceira tabela, pois para sua nomencletura é necessário outras técnicas.
Vamos a um exemplo: você ainda não aprendeu, mas o seguinte composto é um aldeído. Seu nome seria: propenal.