![]()
ความดันไอสมดุลหรือความดันไอของของเหลวคือ ความดันของไอในขณะที่มีค่าคงที่ เมื่อของเหลวอยู่ในภาชนะปิด จะมีอนุภาคของของเหลวที่ระเหยเป็นก๊าซ(ไอ)อยู่ อนุภาคที่เป็นก๊าซนั้นจะมีการเคลื่อนที่ชนกันและชนผนังภาชนะจึงทำให้เกิดความดันไอที่เหนือผิวของของเหลว ถ้าของเหลวนั้นเกิดสมดุลพลวัติและอุณหภูมิคงที่ความดันไอที่เกิดจะมีความคงที่ เรียกว่า ความดันไอสมดุลหรือความดันไอของของเหลว

บริเวณที่เป็นอากาศในภาชนะนี้จะมีความดันไอของของเหลว
การทดลองความดันไอ****
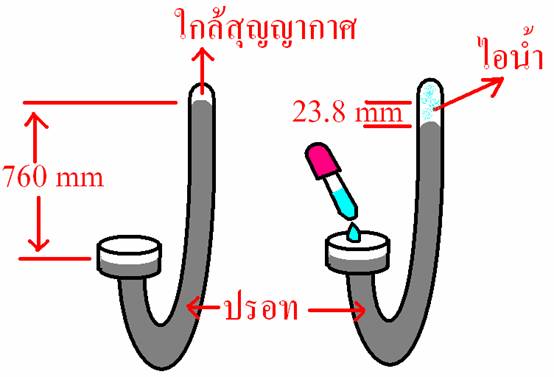
ใช้หลอดแก้วรูปตัวเจบรรจุปรอท เมื่อให้น้ำผ่านเข้าไปในหลอดแก้ว 2 - 3 หยด
ที่อุณหภูมิ25 องศา ระดับปรอทจะลดลง 23.8 มิลลิเมตร และเมื่อเพิ่มน้ำเข้าไปอีก ระดับปรอทจะไม่ลดลงอีกแล้วเพราะไออิ่มตัวแล้วหรือเกิดการสมดุลแล้วระหว่างไอน้ำกับน้ำ ไม่มีเหตุผลที่ยากยากให้หนักใจ มีเพียงเหตุผลที่ง่ายๆที่ระดับปรอทลดลง คือเพราะเกิดจากความดันไอของน้ำเหนือระดับปรอท
ดังนั้น ที่อุณหภูมิ 25 องศา น้ำจะมีความดันไอเท่ากับ 23.8 มิลลิเมตร
<- หลอดที่ 1 ------------------------------------------------- หลอดที่ 2 ->
หลอดที่1 รูปตัวเจปรอททำหน้าที่เป็นบารอมิเตอร์ ปริภูมิเหนือปรอทเกือบจะเป็นสุญญากาศ
หลอดที่2 หยดของเหลวเข้าไป 2 - 3 หยด หรือมากกว่านั้น ของเหลวจะหนีขึ้นส่วนบนของปรอทแล้วระเหยกลายเป็นไอไปบนที่ว่างด้านบนจนอิ่มตัว
ถ้าเป็นน้ำ ที่อุณหภูมิ 25 องศา ระดับปรอทจะลดลง 23.8 mm
ถ้าของเหลวต่างชนิดกัน ความดันไอสมดุลก็จะต่างกันด้วย
รูปข่างล่างนี้เปรียบเทียบความดันไอของของเหลวทั้ง 4 ชนิด ที่อุณหภูมิ 25 องศา และความดันอากาศ 741 ทอร์

จากการทดลองจะเห็นว่าที่อุณหภูมิ 25 องศา
น้ำมีความดันไอ 24 mmHg
เอททิลแอลกอฮอล์มีความดันไอ 50 mmHg
เอทิลอีเทอร์มีความดันไอ 537 mmHg
***ความดันไอกับอุณหภูมิ**
รูปนี้คุ้นๆ เหมือนเคยเห็นเลย
เมื่อให้ความร้อนกับของเหลวมากขึ้น เมื่อร้อน อุณหภูมิสูงขึ้นพลังงานจลน์ของ
แต่ละอนุภาคก็มากขึ้น ความดันไอก็สูงขึ้นตามไปด้วย
******** ความดันไอจะแปรผันตามอุณหภูมิ ********
จากการทดลองด้านบน ถ้าอุณหภูมิต่างกัน ความดันไอของของเหลวจะเปลี่ยนไป ดังกราฟนี้
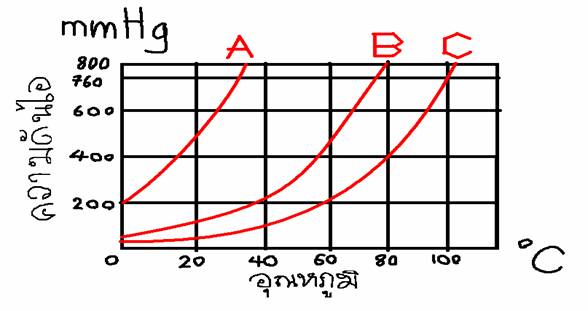
จะเห็นว่าเมื่ออุณหภูมิเพิ่มขึ้น ความดันไอก็จะเพิ่มขึ้นตามไป ของเหลวต่างชนิดกัน ความดันไอของของเหลวที่อุณหภูมิกำหนดให้จะมีค่าต่างดันด้วย
A คือเอทิลอีเทอร์
B คือเอทิลแอลกอฮอล์
C คือ น้ำ
ตารางแสดงความดันไอของน้ำที่อุณหภูมิต่างกัน
อุณหภูมิ |
ความดันไอ (mmHg.) |
อุณหภูมิ (c) |
ความดันไอ (mmHg.) |
0 |
4.6 |
25 |
23.8 |
5 |
6.5 |
30 |
31.8 |
10 |
9.2 |
40 |
55.3 |
15 |
12.8 |
50 |
92.5 |
20 |
17.5 |
60 |
149 |
21 |
18.7 |
70 |
234 |
22 |
19.8 |
80 |
355 |
23 |
21.1 |
90 |
526 |
24 |
22.4 |
100 |
760 |
105 |
906 |
จ้องๆๆๆ
ถ้าเปรียบเทียบ น้ำมัน น้ำ เมทานอล
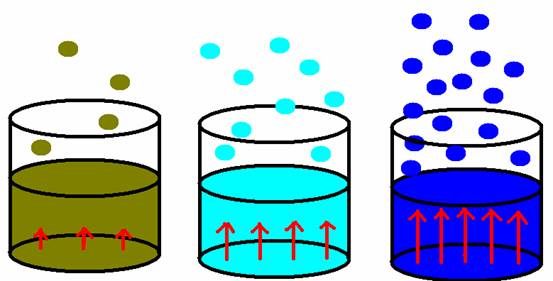
จากรูป จะเห็นว่าอัตราการระเหยของ เมทานอลจะมากสุด และอัตราการระเหยของน้ำมันจะต่ำที่สุด ( จากการจำได้ในเรื่องการระเหย เรื่องแรงระหว่างอนุภาค )
ลูกศรสีแดงๆในรูปแสดงความดันไอ แสดงให้เห็นว่า น้ำมันมีความดันไอต่ำสุด
และเมทานอลมีความดันไอสูงสุด
ถ้าพิจารณาความดันไอ จะได้ว่า เมทานอล > น้ำ > น้ำมัน
ถ้าพิจารณาจุดเดือด จะได้ว่า น้ำมัน > น้ำ > เมทานอล
ถ้าพิจารณแรงระหว่างอนุภาค จะได้ว่า น้ำมัน > น้ำ > เมทานอล
ถ้าพิจารณาความร้อนแฝง จะได้ว่า น้ำมัน > น้ำ > เมทานอล
ถ้าพิจารณการระเหย จะได้ว่า เมทานอล > น้ำ > น้ำมัน
สรุป
ความดันไอ แปรผันตาม อัตราการระเหย
อุณหภูมิ
ความดันไอ แปรผกผันกับ จุดเดือด
ความร้อนแฝง
แรงยึดเหนี่ยวระหว่างอนุภาค