Átomo,
la unidad más pequeña posible de un elemento químico. En la filosofía de la
antigua Grecia, la palabra "átomo" se empleaba para referirse a la parte de
materia más pequeño que podía concebirse. Esa "partícula fundamental", por emplear
el término moderno para ese concepto, se consideraba indestructible. De hecho,
átomo significa en griego "no divisible". El conocimiento del tamaño y la naturaleza
del átomo avanzó muy lentamente a lo largo de los siglos ya que la gente se
limitaba a especular sobre él. Con la llegada de la ciencia experimental en
los siglos XVI y XVII , los avances en la teoría atómica se hicieron más rápidos.
Los químicos se dieron cuenta muy pronto de que todos los líquidos, gases y
sólidos pueden descomponerse en sus constituyentes últimos, o elementos. Por
ejemplo, se descubrió que la sal se componía de dos elementos diferentes, el
sodio y el cloro, ligados en una unión íntima conocida como compuesto químico.
El aire, en cambio, resultó ser una mezcla de los gases nitrógeno y oxígeno.
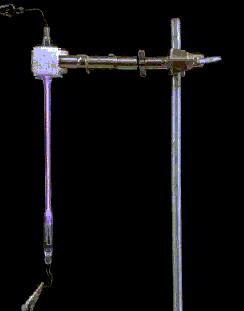
Descarga eléctrica en nitrógeno En este tubo
de descarga lleno de nitrógeno, una corriente eléctrica excita los átomos de
nitrógeno. Casi inmediatamente, dichos átomos se desprenden de su exceso de
energía emitiendo luz de longitudes de onda determinadas. Este fenómeno sólo
se explicó con la llegada de la mecánica cuántica a principios del siglo XX.
Teoría
de Dalton John Dalton, profesor y químico británico, estaba fascinado por el
rompecabezas de los elementos. A principios del siglo XIX estudió la forma en
que los diversos elementos se combinan entre sí para formar compuestos químicos.
Aunque muchos otros científicos, empezando por los antiguos griegos, habían
afirmado ya que las unidades más pequeñas de una sustancia eran los átomos,
se considera a Dalton como una de las figuras más significativas de la teoría
atómica porque la convirtió en algo cuantitativo. Dalton mostró que los átomos
se unían entre sí en proporciones definidas. Las investigaciones demostraron
que los átomos suelen formar grupos llamados moléculas. Cada molécula de agua,
por ejemplo, está formada por un único átomo de oxígeno (O) y dos átomos de
hidrógeno (H) unidos por una fuerza eléctrica denominada enlace químico, por
lo que el agua se simboliza como HOH o H2O. Todos los átomos de un determinado
elemento tienen las mismas propiedades químicas. Por tanto, desde un punto de
vista químico, el átomo es la entidad más pequeña que hay que considerar. Las
propiedades químicas de los elementos son muy distintas entre sí; sus átomos
se combinan de formas muy variadas para formar numerosísimos compuestos químicos
diferentes. Algunos elementos, como los gases nobles helio y argón, son inertes;
es decir, no reaccionan con otros elementos salvo en condiciones especiales.
Al contrario que el oxígeno, cuyas moléculas son diatómicas (formadas por dos
átomos), el helio y otros gases inertes son elementos monoatómicos, con un único
átomo por molécula.

Ley
de Avogadro El estudio
de los gases atrajo la atención del físico italiano Amedeo Avogadro, que en
1811 formuló una importante ley que lleva su nombre. Esta ley afirma que dos
volúmenes iguales de gases diferentes contienen el mismo número de moléculas
si sus condiciones de temperatura y presión son las mismas. Si se dan esas condiciones,
dos botellas idénticas, una llena de oxígeno y otra de helio, contendrán exactamente
el mismo número de moléculas. Sin embargo, el número de átomos de oxígeno será
dos veces mayor puesto que el oxígeno es diatómico. Masa atómica De la ley de
Avogadro se desprende que las masas de un volumen patrón de diferentes gases
(es decir, sus densidades) son proporcionales a la masa de cada molécula individual
de gas. Si se toma el carbono como patrón y se le asigna al átomo de carbono
un valor de 12,0000 unidades de masa atómica (u), resulta que el hidrógeno tiene
una masa atómica de 1,0079 u, el helio de 4,0026, el flúor de 18,9984 y el sodio
de 22,9898. En ocasiones se habla de "peso atómico" aunque lo correcto es "masa
atómica". La masa es una propiedad del cuerpo, mientras que el peso es la fuerza
ejercida sobre el cuerpo a causa de la gravedad. La observación de que muchas
masas atómicas se aproximan a números enteros llevó al químico británico William
Prout a sugerir, en 1816, que todos los elementos podrían estar compuestos por
átomos de hidrógeno. No obstante, medidas posteriores de las masas atómicas
demostraron que el cloro, por ejemplo, tiene una masa atómica de 35,453 (si
se asigna al carbono el valor 12). El descubrimiento de estas masas atómicas
fraccionarias pareció invalidar la hipótesis de Prout hasta un siglo después,
cuando se descubrió que generalmente los átomos de un elemento dado no tienen
todos la misma masa. Los átomos de un mismo elemento con diferente masa se conocen
como isótopos. En el caso del cloro, existen dos isótopos en la naturaleza.
Los átomos de uno de ellos (cloro 35) tienen una masa atómica cercana a 35,
mientras que los del otro (cloro 37) tienen una masa atómica próxima a 37. Los
experimentos demuestran que el cloro es una mezcla de tres partes de cloro 35
por cada parte de cloro 37. Esta proporción explica la masa atómica observada
en el cloro. Durante la primera mitad del siglo XX era corriente utilizar el
oxígeno natural como patrón para expresar las masas atómicas, asignándole una
masa atómica entera de 16. A principios de la década de 1960, las asociaciones
internacionales de química y física acordaron un nuevo patrón y asignaron una
masa atómica exactamente igual a 12 a un isótopo de carbono abundante, el carbono
12. Este nuevo patrón es especialmente apropiado porque el carbono 12 se emplea
con frecuencia como patrón de referencia para calcular masas atómicas mediante
el espectrómetro de masas. Además, la tabla de masas atómicas basada en el carbono
12 se aproxima bastante a la tabla antigua basada en el oxígeno natural.
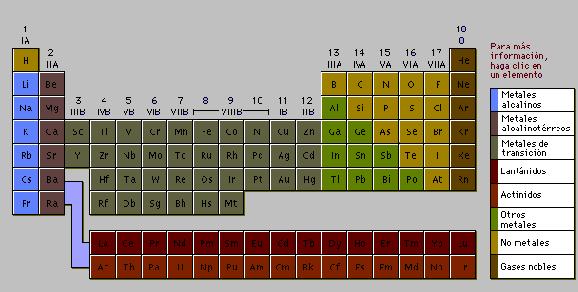
La
tabla periódica. A mediados del siglo
XIX, varios químicos se dieron cuenta de que las similitudes en las propiedades
químicas de diferentes elementos suponían una regularidad que podía ilustrarse
ordenando los elementos de forma tabular o periódica. El químico ruso Dmitri
Mendeléiev propuso una tabla de elementos llamada tabla periódica, en la que
los elementos están ordenados en filas y columnas de forma que los elementos
con propiedades químicas similares queden agrupados. Según este orden, a cada
elemento se le asigna un número (número atómico) de acuerdo con su posición
en la tabla, que va desde el 1 para el hidrógeno hasta el 92 para el uranio,
que tiene el átomo más pesado de todos los elementos que existen de forma natural
en nuestro planeta. Como en la época de Mendeléiev no se conocían todos los
elementos, se dejaron espacios en blanco en la tabla periódica correspondientes
a elementos que faltaban. Las posteriores investigaciones, facilitadas por el
orden que los elementos conocidos ocupaban en la tabla, llevaron al descubrimiento
de los elementos restantes. Los elementos con mayor número atómico tienen masas
atómicas mayores, y la masa atómica de cada isótopo se aproxima a un número
entero, de acuerdo con la hipótesis de Prout