Isomeria é o ramo da Química Orgânica que estuda a ocorrência
de duas os mais substâncias diferentes, que apresentam mesma fórmula
molecular mas fórmulas estruturais diferentes. Muitos compostos
isômeros apresentam características diferenciadas, quando se
fala de Densidade, Ponto de Fusão (PF) e
Ponto de Ebulição (PE). A Isomeria está dividida em
duas partes : Isomeria Plana e Isomeria
Espacial ou Estereoisomeria.
Neste tipo de Isomeria, pode-se verificar a diferença dos isômeros
através da análise de suas fórmulas estruturais. A Isomeria
Plana divide-se em cinco classes :
- Isomeria de Cadeia ou
Isomeria de Núcleo
- Isomeria de Posição
- Isomeria de Função
- Metameria ou Isomeria
de Compensação
- Tautometria ou
Isomeria Dinâmica
1.1. Isomeria de Cadeia ou Núcleo
|
Os isômeros fazem parte de uma mesma função, mas suas
cadeias são diferentes. Exemplos :
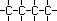 |
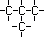 |
 |
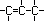 |
| C4H10 |
C4H10 |
C3H6 |
C3H6 |
| Hidrocarboneto |
Hidrocarboneto |
Hidrocarboneto |
Hidrocarboneto |
| Cadeia Aberta, Normal, Saturada,
Homogênea |
Cadeia Aberta,Ramificada,
Saturada, Homogênea |
Cadeia Fechada (Cíclica),
Saturada, Homogênea |
Cadeia Aberta, Insaturada,
Homogênea |
| Butano |
Metil-Propano |
Ciclopropano |
Propeno |
PF
: -135º C
PE : -1º C |
PF
: -145º C
PE : -10º C |
Usado
como anestésico |
Usado
na fabricação de polímeros. |
Os isômeros pertencem à uma mesma função e têm o mesmo
tipo de cadeia, mas apresentam diferença na posição do grupamento
funcional, de uma ramificação ou insaturação.
Exemplos :
 |
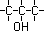 |
|
 |
 |
| C3H8O |
C3H8O |
|
C4H6 |
C4H6 |
| Álcool |
Álcool |
|
Hidrocarboneto |
Hidrocarboneto |
| Cadeia Aberta, Normal, saturada e Homogênea |
Cadeia Aberta, Normal, saturada e Homogênea |
|
Cadeia Aberta, Normal, Insaturada e Homogênea |
Cadeia Aberta, Normal, Insaturada e Homogênea |
| 1-Propanol |
2-Propanol |
|
1-Butino |
2-Butino |
| O grupo funcional (OH) está no carbono 1 |
O grupo funcional (OH) está no carbono 2 |
|
A ligação tripla está no carbono 1 |
A ligação tripla está no carbono 2 |
PF
: -126º C
PE : 96º C
|
PF
: -86º C
PE : 82,5º C
|
|
Reage
com Sódio metálico
|
Não
reage com Sódio metálico
|
Isômeros de função são aqueles que possuem fórmula
estrutural e cadeia idênticas, mas pertencem à funções
diferentes. Exemplos :
 |
 |
|
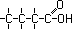 |
 |
|
 |
 |
| C3H6O |
C3H6O |
|
C4H8O2 |
C4H8O2 |
|
C7H8O |
C7H8O |
| Aldeído |
Cetona |
|
Ácido Carboxílico |
Éster |
|
Fenol |
Álcool |
| Propanal |
Propanona |
|
Ácido Butanóico |
Etanoato de Etila |
|
Orto-Metil-Hidróxi-Benzeno |
Álcool Benzílico |
| Utilizado como mordente na indústria de
tinturaria |
Solvente Orgânico. Vendido com o nome comercial
de Acetona. |
|
Presente na manteiga rançosa |
Essência responsável pelo sabor de maçã. |
|
Matéria prima usada na fabricação do
desinfetante conhecido como Creolina |
Álcool extraído na resina de certas árvores. |
1.3. Isomeria de Compensação ou
Metameria
|
Os isômeros pertencem a uma mesma função e apresentam
cadeias idênticas, mas apresentam uma diferença na posição de
um heteroátomo. A palavra metameria vem do grego meta
(mudança) + meros (parte).
Exemplos :
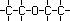 |
 |
|
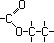 |
 |
| C4H10O |
C4H10O |
|
C3H6O2 |
C3H6O2 |
| Éter |
Éter |
|
Éster |
Éster |
| Etóxi-Etano |
Metóxi-propano |
|
Metanoato de Etila |
Etanoato de Metila |
| Utilizado como anestésico comum |
Utilizado em processos industriais |
|
O heteroátomo está entre os carbonos 1
e 2 |
O heteroátomo está entre os carbonos 2
e 3 |
| Cadeia
normal, aberta, saturada e heterogênea |
Cadeia
normal, aberta, saturada e heterogênea |
|
Cadeia
normal, aberta, saturada e heterogênea |
Cadeia
normal, aberta, saturada e heterogênea |
1.4. Isomeria Dinâmica ou
Tautomeria
|
| Os principais casos de tautomeria (que
vem do grego tautos = dois de si mesmo)
envolvem os Enóis, que são Álcoois que
possuem a hidroxila (-OH) presa a um carbono insaturado.
Os enóis se transformam em Aldeídos quando o carbono
insaturado é primário e em cetonas quando o carbono é
secundário. Os compostos originados a partir dos enóis
apresentam tendência a se transformar novamente nos enóis,
fazendo com que o ciclo se reinicie. Quando o Enol se
transforma em Aldeído, dizemos que houve um equilíbrio Aldo-enóico
e quando o Enol se tranforma em Cetona, houve um equilíbrio
Ceto-enóico.Uma solução que contém os dois
tautômeros é chamada Solução Alelotrópica.
Exemplos : |
 Olha Lá ! Olha Lá !
As Cetonas
não se transformam em Aldeídos e vice-cersa. A
transformação só ocorre entre Enol e Cetona ou Enol e
Aldeído. O Enol que se trasnforma em Cetona é diferente
do Enol que se transforma em Aldeído.
|
| |
|
|
 |
|
 |
| Enol com Carbono Primário |
Áldeído |
|
Enol com Carbono Secundário |
Cetona |
| Etenol |
Etanal |
|
2-2-Butenol |
Butanona |
Isomeria Geométrica ou Isomeria
Cis-Trans
|
Este tipo de isomeria descreve os elementos onde os seus
grupamentos funcionais ou ramificações estão orientadas de
maneira diferente, tornando os compostos diferentes. Estes
compostos, entretanto, possuem mesma fórmula estrutural (e por
conseqüencia a mesma fórmula molecular), mas apresentam
propriedades físicas diferentes. Tomemos como exemplo o 1,2-Cloro-Eteno.
Quando se pensa neste composto, de fórmula molecular C2H2Cl2,
pode-se montar duas estruturas diferentes, que possuem o mesmo
nome (1,2-Cloro-Eteno).
 |
 |
| Ponto
de Fusão : - 80,5 ºC |
Ponto
de Fusão : - 50 ºC |
| Ponto
de Ebulição : 60,3 ºC |
Ponto
de Ebulição : 47,5 ºC |
| Densidade
a 20 ºC : 1,284 g/mL |
Densidade
a 20 ºC : 1,265 g/mL |
Então, para diferenciar, foi criado um antecedente para ser
colocado no nome de cada isômero, para diferenciar sua fórmula
estrutural. Os antecedentes são cis (do latim,
significa próximo a) e trans (também
latino, significa através de). Veja então como ficou o
nome dos isômeros do 1,2-Cloro-Eteno :
 |
 |
| Cis-1,2-Cloro-Eteno |
Trans-1,2-Cloro-Eteno. |
| 1. Ocorrências da Isomeria Geométrica
em Compostos Acíclicos (Abertos) |
Para ocorrer casos de Isomeria Geométrica em compostos
abertos, o composto deve ter uma ligação dupla entre os
carbonos e cada um dos carbonos da ligação dupla deve ter seus
ligantes diferentes. Veja o esquema :

Vale observar que para que exista a Isomeria, o ligante 1 tem
que ser diferente do ligante 3 e o ligante 2 tem que ser
diferente do ligante 4. Veja os exemplos :

Como existe ligação dupla entre carbonos e cada carbono da
ligação dupla apresenta grupos ligantes diferentes, conclui-se
que ele apresenta isômeros geométricos. Para determinar a
estrutura de seus isômeros geométricos (cis e trans),
analisam-se os grupos ligantes dos carbonos da ligação dupla :
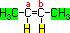
Pode-se obervar que os ligantes dos carbonos A
e B são iguais. Quando isto acontece, basta traçar
uma linha imaginária na estrutura plana do composto e observar
que o isômero Cis será aquele que apresentar
os mesmos ligantes do carbono A e B
no mesmo lado, enquanto o isômero Trans
apresentará os mesmos grupos ligantes em lados opostos da linha.
Observe abaixo :
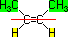 |
 |
Cis-2-Buteno
|
Apresenta
os mesmos ligantes no mesmo lado da linha imaginária
|
|
Trans-2-Buteno
|
Apresenta
os mesmos ligantes em lados opostos da linha
imaginária
|
|
Há casos onde pelo menos três dos quatro ligantes são
diferentes entre si, e pode haver dificuldade de determinar a
estrutura dos isômeros Cis e Trans.
Veja o exemplo com o composto 2-Cloro-2-Buteno :
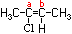
O Carbono A possui como ligantes H3C-
e Cl- , enquanto o Carbono B
possui CH3- e H-
. Para determinar a estrutura de isômeros de casos como o do
exemplo, utiliza-se uma série de regras propostas por Cohn,
Ignold e Prelog, baseadas numa escala de prioridade.
De acordo com esta escala, a maior prioridade é do grupo ligante
que apresenta o átomo de maior número atômico e que estiver
ligado diretamente ao carbono da ligação dupla. Ou seja, será
considerado Cis o composto que apresentar, no
mesmo lado da linha imaginária, ligantes dos carbonos da ligação
dupla com maior número atômico.
Para aplicar esta regra no exemplo
dado, deve-se saber que o número atômico do Carbono é 6,
do Hidrogênio é 1 e
do Cloro é 17.
No Carbono A, o ligante que apresenta
maior prioridade (maior número atômico) é o Cl-
, enquanto no Carbono B é o CH3-
. Conlui-se então que o isômero Cis
é o que apresenta estes grupos no mesmo lado da linha
imaginária e que o isômero Trans é o
que apresenta estes grupos em lados opostos. |
 Olha Lá ! Olha Lá !
Estas
regras são válidas para todos os casos de Isomeria Geométrica.
|
 |
 |
Cis-2-Cloro-2-Buteno
|
Apresenta
os ligantes com maior número atômico no mesmo
lado da linha imaginária
|
|
Trans-2-Cloro-2-Buteno
|
Apresenta
os grupos ligantes de maior prioridade em lados
opostos da linha imaginária.
|
|
Estas regras também propõem a utilização de novos símbolos
- E e Z - para substituir Trans
e Cis, onde E (do alemão Entgegen,
oposto) substitui o Trans e o Z (do
alemão Zusammen, do mesmo lado) substitui o Cis.
Com isso, o nome dos compostos podem ser :
- (Z)-2-Cloro-2-Buteno, que equivale ao
Cis-2-Cloro-2-Buteno
- (E)-2-Cloro-2-Buteno, equivalente ao
Trans-2-Cloro-2-Buteno
| 2. Ocorrência de Isomeria Geométrica
em Compostos Cíclicos (Fechados) |
Os compostos fechados devem apresentar grupos ligantes
diferentes em pelo menos dois carbonos do ciclo. Veja o esquema
abaixo :

Onde é importante observar que o ligante 1
é diferente do ligante 2 e o ligante 3
é diferente do ligante 4. Veja o exemplo com o
1,2-Dicloro-Ciclopropano :
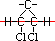
Veja agora seus isômeros geométricos :
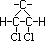 |
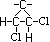 |
Cis-1,2-Dicloro-Ciclopropano
ou (Z)-1,2-Dicloro-Ciclopropano
|
Apresenta
os mesmos grupos ligantes ou, de acordo com a
regra de prioridade, os grupos ligantes de
maiores prioridade se encontram no mesmo lado da
linha imaginária
|
|
Trans-1,2-Dicloro-Ciclopropano
ou (E)-1,2-Dicloro-Ciclopropano
|
Apresenta
os mesmos grupos ligantes em lados opostos da
linha imaginária ou, de acordo com a regra da
prioridade, os grupos ligantes de maior número
atômico se encontram em lados opostos da linha
imaginária.
|
|