
![]()
|
|
|
|
|
Tratamiento con Yodo-131
Generalmente el tejido tiroideo, benigno o maligno, con capacidad de producir hormonas tiroideas, es capaz de captar y organificar el yodo estable y sus isótopos radioactivos. En este principio se basa la terapia con radioyodo: Los efectos terapéuticos se dan por el poder destructor de la radiación ionizante en forma de partículas ß de alta energía emitidas por la desintegración del yodo-131, que ocasiona muerte celular en un período de semanas a meses después de su administración.
Existen algunos factores que determinan la radiación recibida por el tejido tiroideo funcionante y condicionan su efectividad como agente terapéutico:
-
El grado de captación de 131I
-
Cantidad de tejido a ser destruído
-
Tiempo de permanencia del 131I en los tejidos
-
Distribución tisular del 131I
-
Radiosensibilidad de las células tiroideas
Hipertiroidismo Primario
El tratamiento clásico de esta entidad comprende (1) Medicamentos antitiroideos, como el metimazol (Tapazol®) y el propiltiuracilo (Tirostat®); (2) terapia con radioyodo y (3) cirugía.
El tratamiento inicial se realiza frecuentemente con antitiroideos; sin embargo, estos no se utilizan generalmente en el tratamiento de nódulos tóxicos o bocio multinodular. Un número significativo de pacientes pueden presentar efectos secundarios intolerables; poco control de la enfermedad o pueden presentar alteraciones sanguíneas.
Los métodos utilizados para el cálculo de la dosis de radioyodo varían dependiendo de la institución y grupo médico. Básicamente se utilizan dos tipos de protocolos: Aquellos que utilizan bajas dosis y los que utilizan altas dosis; la diferencia está en la rapidez con la que se quiere llevar al paciente hacia el hipotiroidismo.
En las terapias con dosis bajas se busca reducir la incidencia de hipotiroidismo en el primer año después de la dosis ablativa y se tolera la morbilidad asociada con el hipertiroidismo prolongado.
En las terapias con altas dosis se busca disminuír rápidamente el hipertiroidismo del paciente y llevarlo al hipotiroidismo, con menos morbilidad para el paciente.
En ambos casos existen dosis fijas o dosis variables, que utilizan fórmulas para el cálculo de la cantidad de radioyodo a administrar teniendo en cualta (1) el tamaño de la glándula (2) la presencia o ausencia de nodularidad, (3) los resultados de la gamagrafía con cálculo del porcentaje de captación de 131I y (4) enfermedades asociadas, agravadas por el hipertiroidismo, como cardiopatía.
En particular, en nuestro grupo (Grupo de tiroides del Hospital Universitario San Vicente de Paúl, Medellín, Colombia) se utlilizan dosis fijas, de acuerdo al tipo de hipertiroidismo y edad del paciente. En pacientes con Enfermedad de Grave's no complicada y con bocios no muy grandes, se administran entre 8 y 15 mCi. En pacientes con la misma entidad y con grandes bocios, nodularidad o cadiopatía, se administran entre 12 - 20 mCi.
El hipertiroidismo ocasionado por un bocio nodular tóxico (Enfermedad de Plummer) requiere dosis de 21 a 30 mCi y para el tratamiento del bocio multinodular tóxico, grande, se requieren dosis ablativas de hasta 30 - 35 mCi.
Los resultados, a pesar del cálculo individualizado de la dosis, dependen de varios factores:
-
Radiosensibilidad de las células tiroideas
-
Nodularidad de la glándula
-
Raza (Existe mayor radioresistencia en la raza negra)
-
Tratamiento antitiroideo previo
-
Hipertiroidismo severo por el rápido recambio del yodo
El hipotiroidismo es la principal complicación. Ocurre en un 10% en el primer año después de la administración del radioyodo y posteriormente tiene un incremento anual de 3-5% hasta los 20 años posterapia ablativa. No existe evidencia de incremento en la incidencia de cáncer o leucemia. Tampoco se ha asociado a cambios en la fertilidad o daño genético.
Otras complicaciones son raras e incluyen: Sialoadenitis, Cistitis y Gastritis. La tormenta tiroidea se ha reportado en algunos casos, con una incidencia del 0,1%
En pacientes con Enfermedad de Graves y orbitopatía, el hipotiroidismo posterapia con yodo puede agravar el exoftalmos.
Antes de la administración de una dosis terapéutica de yodo-131, se debe establecer el diagnóstico de bocio difuso tóxico ó bocio multinodular tóxico y excluir otras causas de hipertiroidismo, no tratables con radioyodo, como tiroiditis en sus varias formas de presentación.
El paciente debe consumir un desayuno ligero, en caso de pacientes de sexo femenino debe excluirse un embarazo debido al bajo pero posible riesgo de carcinogénesis en el feto y el daño en la tiroides fetal después del primer trimestre. En madres lactantes debe instruirse para deshechar la leche, pues el radioyodo se excreta por esta vía.
Los pacientes con hipertiroidismo severo deben estar eutiroideos en el momento de la administración del yodo para evitar un empeoramiento de los síntomas o una tormenta tiroidea que resulta de la liberación rápida de hormonas almacenadas en el tejido tiroideo que se está destruyendo.
Los medicamentos antitiroideos deben suspenderse 5 días antes y, de ser necesario, se administrarán nuevamente 5 días luego de la terapia. Los betabloqueadores y otros medicamentos que no afecten la captación del radioyodo pueden continuarse durante el tratamiento.
El paciente debe tomar abundantes líquidos y eliminar lo más frecuentemente posible, para reducir la dosis de radiación en la vejiga y en el resto de los tejidos.
Generalmente existe una mejoría en los síntomas a las 3-6 semanas y se puede observar una disminución del tamaño del bocio a los 3-4 meses.
Si a pesar de haberse administrado una dosis de yodo bien calculada e individualizada el paciente continúa hipertiroideo, se puede administrar una segunda dosis a los 6-12 meses.
Las mujeres en edad reproductiva deben planificar al menos 6 meses después de la terapia, especialmente para tratar el posible hipertiroidismo o definir una posible segunda dosis.
El 90% de todos los carcinomas tiroideos son bien diferenciados y tienen la propiedad de captar el yodo 131 (131I), lo que los hace suceptibles de tratamiento con terapia ablativa con este isótopo, después de tratamiento quirúrgico.
Un 80-90% de los carcinomas tiroideos bien diferenciados son de tipo papilar. Este ocurre más comunmente en mujeres, con una incidencia dos veces mayor, y una edad media de presentación de 45 años. En la mayoría de los casos se presentan como nódulos hipocaptantes solitarios y en algunas oportunidades como multifocales.
Clasificación de los tumores de tiroides (OMS)
|
I. Tumores epiteliales A. Benignos 1. Adenoma 2. Otros B. Malignos 1. Carcinoma Folicular 2. Carcinoma Papilar 3. Carcinoma Medular 4. Carcinoma Indiferenciado o anaplásico 5. Otros II. Tumores no epiteliales A. Benignos B. Malignos III. Linfomas malignos IV. Tumores varios V. Tumores secundarios VI. Tumores no clasificados VII. Lesiones que semejan tumores |
Usualmente el carcinoma papilar da metástasis a ganglios regionales. 10-20% de los carcinomas tiroideos son foliculares y ocurren en una edad media de 50 a 55 años de edad; dan metástasis más comunmente por vía hematógena a los pulmones y a hueso y de forma menos comun a cerebro e hígado.
El pronóstico en general de los pacientes con carcinoma tiroideo bien diferenciado es bueno, con una sobrevida a 5 años de más del 95%, cuando se realiza el tratamiento adecuado.
Existe un porcentaje remanente de carcinomas anaplásicos o mal diferenciados (5%) y ocurren principalmente en pacientes de mayor edad. El pronóstico es malo en términos generales.
Un 5% lo ocupan los carcinomas medulares de tiroides. Este tipo de cáncer se asocia con otras lesiones endocrinas (Neoplasia Endocrina Múltiple o MEN) y puede ser activo metabólicamente (secretando hormonas, más comunmente calcitonina) y puede ser de incidencia familiar.
Factores de riesgo en cáncer tiroideo
|
I. Antecedentes personales de radiación externa en cuello II. Antecedentes familiares de carcinoma medular o Neoplasia endocrina múltiple (NEM) tipo 2 III. Nódulo tiroideo con estas características: A. Crecimiento rápido B. Aumento en la consistencia C. Fijación a tejidos adyacentes D. Ganglios cervicales aumentados de tamaño, especialmente en niños
|
El porcentaje restante (5%) corresponde al carcioma de células de Hürtle, que es una variante del carcinoma folicular. La mayoría de los carcinomas tiroideos no diferenciados no captan el radioyodo y por lo tanto no son suceptibles de recibir tratamiento ablativo con yodo.
Tratamiento del cáncer diferenciado de tiroides
Nuestro grupo de tiroides (Hospital Universitario San Vicente de Paúl y Facultad de Medicina de la Universidad de Antioquia, Medellín, Colombia), recomienda la tiroidectomía total, basados en:
1. Hasta un 10% del carcinoma bien diferenciado puede ser multifocal y oculto
2. El seguimiento con el marcador tumoral tiroglobulina es más específico ante la ausencia completa de tejido tiroideo
3. Las imágenes con 131I tienen mayor sensibilidad para la detección de metástasis ante la ausencia de tejido tiroideo
| Rastreo Corporal Total con Yodo-131 | |
 |
Luego de la tiroidectomía total o subtotal, debe hacerse un rastreo corporal total con 131I a las 4 - 6 semanas después, con deprivación de la terapia hormonal de reemplazo para que ocurra estimulación endógena de la TSH, que debe ser mayor de 30 mUI/ml. Para el rastreo se administran 2-3 mCi de 131I y se realizan imágenes de cuerpo entero a las 48 - 72 horas. El uso de más de 3 mCi de yodo podría ocasionar aturdimiento del tejido tiroideo residual, con falsos negativos. |
Dependiendo de los resultados del rastreo inicial, se continuará con el algoritmo propuesto:
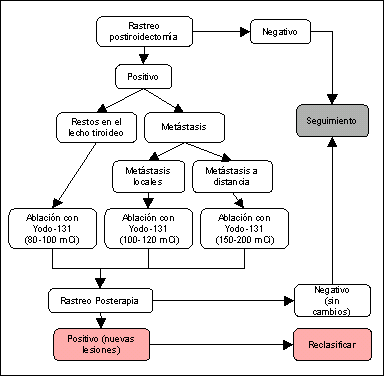
Fig. 1. Algoritmo para el tratamiento ablativo con 131I en cáncer de tiroides
El seguimiento se hará de acuerdo con el siguiente algoritmo:
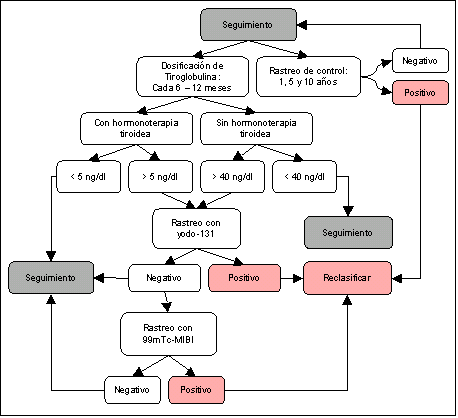
Fig. 2. Algoritmo para el seguimiento de pacientes con cáncer de tiroides
