พันธะเคมี Chemical Bond
|
Link แนะนำ พันธะเคมีของครูมนตรี (เน้นamination) |
พันธะเคมี แบ่งเป็น 3 ประเภทหลักๆคือ
พันธะโลหะ

(Metallic bonding) เป็นพันธะภายใน โลหะ ซึ่งเกี่ยวข้องกับ การเคลื่อนย้าย อิเล็กตรอน อิสระระหว่างแลตทิซของอะตอมโลหะ ดังนั้นพันธะโลหะจึงอาจเปรียบได้กับเกลือที่หลอมเหลว อะตอม ของ โลหะ มี อิเล็กตรอน พิเศษเฉพาะใน วงโคจร ชั้นนอกของมันเทียบกับคาบ (period) หรือ ระดับพลังงานของพวกมัน อิเล็กตรอนที่เคลื่อนย้ายเหล่านี้เปรียบได้กับทะเลอิเล็กตรอน (Sea of Electrons) ล้อมรอบแลตทิชขนาดใหญ่ของไอออน บวก
พันธะโลหะเทียบได้กับ พันธะโควาเลนต์ ที่เป็น นอน-โพลาร์ ที่จะไม่มีในธาตุโลหะบริสุทธ์ หรือมีน้อยมากใน โลหะผสม ความแตกต่าง อิเล็กโตรเนกาทิวิตี ระหว่าง อะตอม ซึ่งมีส่วนในปฏิกิริยาพันธะ และอิเล็กตรอนที่เกี่ยวข้องในปฏิกิริยาจะเคลื่อนย้ายข้ามระหว่างโครงสร้างผลึกของโลหะ
พันธะโลหะจะมีความสำคัญต่อคุณสมบัติทางฟิสิกส์หลายอย่างของโลหะเช่น
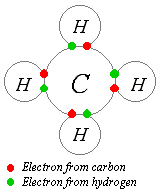
พันธะโควาเลนต์ (อังกฤษ:Covalent bond) คือพันธะเคมี (chemical bond) ภายในโมเลกุลชนิดหนึ่ง พันธะโควาเลนต์เกิดจากอะตอมสองอะตอมใช้วาเลนซ์อิเล็กตรอนหนึ่งคู่หรือมากกว่าร่วมกัน ทำให้เกิดแรงดึงดูดที่รวมอะตอมเป็นโมเลกุลขึ้น อะตอมมักสร้างพันธะโควาเลนต์เพื่อเติมวงโคจรอิเล็กตรอนรอบนอกสุดของตัวเองให้เต็ม ดังนั้นอะตอมที่สร้างพันธะโควาเลนต์จึงมักมีวาเลนซ์อิเล็กตรอนอยู่มาก เช่น ธาตุหมู่ VI และหมู่ VII เป็นต้น พันธะโควาเลนต์แข็งแรงกว่าพันธะไฮโดรเจนและมีความแข็งแรงพอๆ กับพันธะไอออนิก
พันธะโควาเลนต์มักเกิดขึ้นระหว่างอะตอมที่มีค่าอิเล็กโตรเนกาทิวิตีใกล้เคียงกัน ธาตุอโลหะมีแนวโน้มที่จะสร้างพันธะโควาเลนต์มากกว่าธาตุโลหะซึ่งมักสร้างพันธะโลหะ เนื่องจากอิเล็กตรอนของธาตุโลหะสามารถเคลื่อนอย่างอิสระ ในทางกลับกัน อิเล็กตรอนของธาตุอโลหะไม่สามารถเคลื่อนที่ได้อย่างอิสระนัก การใช้อิเล็กตรอนร่วมกันจึงเป็นทางเลือกเดียวในการสร้างพันธะกับธาตุที่มีสมบัติคล้ายๆ กัน อย่างไรก็ดี พันธะโควาเลนต์ที่มีโลหะนั้นมีความสำคัญอย่างยิ่งในการเร่งปฏิกิริยา ตัวอย่างเช่น พันธะโควาเลนต์ระหว่างสารอินทรีย์กับโลหะเป็นเครื่องมือสำคัญของกระบวนการสร้างพอลิเมอร์หลายๆ กระบวนการ เป็นต้น
พันธะไอออนิค (พันธะไอออน) (ionic bond) เกิดจากอะตอมตั้งแต่ 2 อะตอมขึ้นไป ให้อิเล็กตรอนแก่กัน ทำให้กลายเป็นไอออน พันธะชนิดนี้มักเกิดขึ้นระหว่างโลหะกับอโลหะ อะตอมที่ให้อิเล็กตรอนมักเป็นโลหะ ทำให้โลหะนั้นมีประจุบวก และอะตอมที่รับอิเล็กตรอนมักเป็นอโลหะ จึงมีประจุลบ ไอออนที่มีประจุตรงกันข้ามกันจะดึงดูดกัน ทำให้เกิดพันธะไอออน พันธะไอออนมีความแข็งแรงมากกว่าพันธะไฮโดรเจน แต่แข็งแรงพอ ๆ กับพันธะโคเวเลนต์

| พันธะระหว่างโมเลกุลที่มีอิทธิพลต่อแรงยึดเหนี่ยวของสารคือ พันธะไฮโดรเจน
พันธะไฮโดรเจน คือ พันธะที่เกิดขึ้นอันเนื่องมาจากแรงดึงดูดระหว่างโมเลกุลสองโมเลกุล ซึ่งแต่ละโมเลกุลนั้นประกอบด้วยอะตอมของไฮโดรเจนสร้างพันธะโคเวเลนต์กับอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตี (en) สูงมากๆ เช่น F, O และ N ซึ่งมีค่าอิเล็กโทรเนกาติวิตีประมาณ 3.98, 3.44 และ 3.04 ตามลำดับ นอกจากพันธะไฮโดรเจน ยังมีแรงแวนเดอวาลส์
| ||