ปริมาณสารสัมพันธ์

ปริมาณสารสัมพันธ์ คือ
ความสัมพันธ์ระหว่างมวลหรือน้ำหนักของธาตุต่าง ๆ ของสารประกอบในปฏิกิริยาเคมี
ปริมาณสารสัมพันธ์มีประโยชน์ในแง่ของการคาดคะเนปริมาณของสารที่ต้องใช้เป็นสารตั้งต้นเพื่อให้เกิดผลิตภัณฑ์ที่ต้องการ
1 ระบบกับสิ่งแวดล้อม
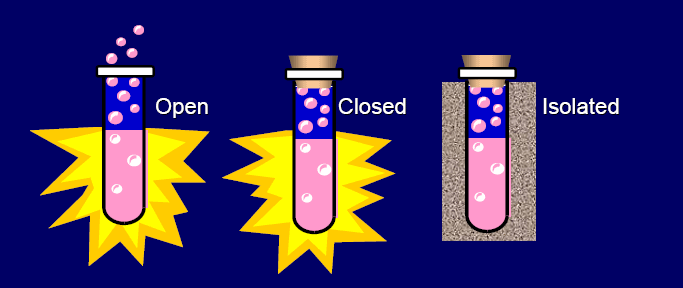
ระบบ คือ สิ่งต่าง ๆ ที่อยู่ภายในขอบเขตที่กำลังศึกษา ส่วนที่อยู่รอบ ๆ ระบบเรียกว่า สิ่งแวดล้อม
ระบบแบ่งออกเป็น 3 ชนิด คือ
1. ระบบปิด (closed system) คือ ระบบที่มีการแลกเปลี่ยนหรือถ่ายโอนพลังงานกับสิ่งแวดล้อมได้ แต่ถ่ายโอน
หรือแลกเปลี่ยนมวลกับสิ่งแวดล้อมไม่ได้ หรือมวลของระบบคงที่เมื่อเกิดการเปลี่ยนแปลง เช่น การต้มน้ำในภาชนะปิดบน
เตาไฟ ระบบคือภาชนะที่มีน้ำบรรจุอยู่ภายใน ส่วนเตาไฟและอากาศที่ล้อมรอบทั้งหมดเป็นสิ่งแวดล้อม ระบบจะรับความ
ร้อนจากเตาไฟแล้วกลายเป็นไอคายพลังงานให้กับสิ่งแวดล้อม
(มีการแลกเปลี่ยนหรือถ่ายโอนพลังงาน)
เมื่อชั่งน้ำหนักของ
ภาชนะที่บรรจุน้ำก่อนการต้มและหลังการต้มในภาชนะปิดจะเท่ากัน
(มวลของระบบคงที่)
2. ระบบเปิด (open system) คือ ระบบที่มีการแลกเปลี่ยนหรือถ่ายโอนทั้งพลังงานและมวลให้กับสิ่งแวดล้อม หรือ
มวลของระบบไม่คงที่เมื่อเกิดการเปลี่ยนแปลง เช่น การต้มน้ำในภาชนะเปิดบนเตาไฟ
ระบบคือ ภาชนะเปิดที่มีน้ำบรรจุอยู่
เตาไฟและอากาศที่ล้อมรอบทั้งหมดคือสิ่งแวดล้อม ระบบที่มีการรับความร้อนจากเตาไฟและคายความร้อนให้กับสิ่งแวดล้อม
(มีการแลกเปลี่ยนหรือถ่ายโอนพลังงาน) เมื่อชั่งน้ำหนักของภาชนะกับน้ำก่อนการต้มและหลังการต้มจะไม่เท่ากัน (มวลของ
ระบบไม่คงที่)
3. ระบบโดดเดี่ยว (แยกตัวหรือเอกเทศ) คือ ระบบที่ไม่เกิดการแลกเปลี่ยนพลังงานหรือมวลสารกับสิ่งแวดล้อม เช่น
น้ำร้อนในกระติกน้ำร้อน
2 กฎต่าง ๆ ที่เกี่ยวข้องกับการเปลี่ยนแปลง
2.1 กฎทรงมวล
อองตวน โลรอง ลาวัวซิเอ ได้ตั้งกฎทรงมวลซึ่งสรุปได้ว่า "มวลของสารทั้งหมดก่อนทำปฏิกิริยาย่อมเท่ากับมวลของสารทั้งหมดหลังทำปฏิกิริยา" กฎนี้จะใช้ได้กับปฏิกิริยาเคมีในระบบปิด ใช้ไม่ได้กับปฏิกิริยาเคมีนิวเคลียร์ เช่น เทียนไข
ในภาชนะปิดใบหนึ่ง มวลของสารทั้งหมดก่อนทำปฏิกิริยาเท่ากับมวลของเทียนไขกับภาชนะ เมื่อจุดเทียนไขในภาชนะปิดนี้
แล้วทำการชั่งมวลใหม่ มวลจะเท่าเดิม (ระบบปิด)
2.2 กฎสัดส่วนคงที่
โจเซฟ
เพราสต์ ได้ตั้งกฎสัดส่วนคงที่ซึ่งสรุปได้ว่า "ในสารประกอบหนึ่ง ๆ
ธาตุต่าง
ๆ ที่เป็นองค์ประกอบรวมตัวกันด้วยอัตราส่วนโดยน้ำหนักที่คงที่เสมอ" โดยไม่คำนึงถึงว่าสารประกอบนั้นจะมีกำเนิดหรือเตรียมได้โดยวิธีใด
3 มวลอะตอม
อะตอมเป็นอนุภาคที่เล็กที่สุดของธาตุที่สามารถทำปฏิกิริยาเคมีได้
มีรัศมีของ
อะตอมยาวประมาณ 10-10 เมตร
อะตอมที่เบาที่สุดมีมวลประมาณ 1.6 x 10-24 กรัม อะตอมที่หนักที่สุดมีมวลประมาณ 250 เท่า ซึ่งมีค่าน้อยมาก (เป็นผลคูณของ 10-24) มวลอะตอมเหล่านี้จะต้องรวมกันต่อไปเป็นมวลโมเลกุล ซึ่งทำให้ยุ่งยากในการคำนวณ จึงนิยมใช้มวลเปรียบเทียบที่เรียกว่า มวลอะตอมหรือน้ำหนักอะตอม
มวลอะตอม คือ มวลเปรียบเทียบที่บอกให้ทราบว่ามวลของธาตุ 1 อะตอมหนักเป็นกี่เท่าของมวลของธาตุมาตรฐาน 1 อะตอม
มวลของธาตุ 1 อะตอม คือ มวลที่แท้จริงของอะตอมนั้น ๆ 1 อะตอม
มวลของธาตุมาตรฐาน 1 อะตอม
คือ มวลของธาตุที่ถูกใช้เป็นตัวเปรียบเทียบ ซึ่ง
ทุกอะตอมต้องมีค่าเท่ากันหมดจึงเรียกว่ามวลมาตรฐาน
มีค่าเท่ากับ 1.66 x 10-24 กรัม
หรือ 1 amu (atomic mass unit)
สรุป...มวลอะตอม (อังกฤษ: Atomic mass) คือมวลของอะตอมหรือไอโซโทปอย่างหนึ่งของธาตุใด ๆ มีหน่วยเป็น หน่วยมวลอะตอมหรือเอเอ็มยู (Atomic Mass Unit - AMU) โดย 1 เอเอ็มยู มีค่า 1.66 x 10-24 กรัม โดยน้ำหนักนี้เทียบมาจาก ไฮโดรเจนอะตอม 1 อะตอม หรือ 1/12 ของคาร์บอน-12 1 อะตอม หรือ 1/16 ของออกซิเจนอะตอม 1 อะตอม
ลักษณะสำคัญของมวลอะตอม มีดังนี้
1. มวลอะตอมของธาตุไม่มีหน่วย
2. มวลอะตอมเป็นค่าเปรียบเทียบ ส่วนมวลของธาตุ
1 อะตอมเป็นมวลที่แท้จริง มีหน่วยเป็นกรัม
3.
มวลของธาตุมาตรฐาน 1 อะตอม ที่ใช้เป็นตัวถูกเปรียบเทียบของมวลอะตอมมีค่าเท่ากันหมดในทุก
ๆธาตุ
4. คำนวณได้จากสูตรเมื่อทราบมวลของธาตุนั้น
1 อะตอม และคำนวณได้จากไอโซโทปของธาตุนั้น ๆ
4 ขนาดโมเลกุล
โมเลกุล คือ หน่วยโครงสร้างที่เล็กที่สุดของธาตุที่สารประกอบที่สามารถอยู่ได้เป็นอิสระ และยังคงแสดงสมบัติของธาตุหรือสารประกอบนั้น ๆ โดยสมบูรณ์ โมเลกุลเกิดจากอะตอมรวมกัน
5 มวลโมเลกุล
เนื่องจากโมเลกุลมีขนาดเล็กมากเช่นเดียวกับอะตอม
ดังนั้น มวลของโมเลกุลจึงนิยมบอกเป็นค่าเปรียบเทียบ
5.1 ลักษณะสำคัญของมวลโมเลกุล
1. มวลโมเลกุลไม่มีหน่วย เพราะเป็นค่าเปรียบเทียบกับค่ามาตรฐาน
2. มวลของสาร 1 โมเลกุล คือมวลที่แท้จริงของโมเลกุลนั้น ๆ 1 โมเลกุล
3. มวลโมเลกุลคำนวณได้จากมวลอะตอมรวมกัน เพราะโมเลกุลเกิดจากอะตอมรวมกัน หรือได้จากมวลของสาร1 โมเลกุล เปรียบเทียบค่ามาตรฐาน
4. มวลมาตรฐานที่ถูกเปรียบเทียบต้องมีค่าเท่ากันหมดในทุก ๆ โมเลกุล
5.2 การคำนวณมวลโมเลกุลของสาร
แบบที่ 1 เมื่อรู้มวลอะตอมของอะตอมที่ประกอบกันเป็นโมเลกุล
มวลโมเลกุลของสาร = มวลอะตอมของธาตุในโมเลกุลรวมกัน
ตัวอย่างที่ 3.4 จงหามวลโมเลกุลของ CaSO4 . 2H2O กำหนดมวลอะตอมของ Ca = 40, S = 32, O = 16 และ H = 1
วิธีทำ มวลโมเลกุลของ CaSO4 . 2H2O = มวลอะตอมของทุกธาตุใน CaSO4 . 2H2O รวมกัน
= 40+32+(16 x 4)+2(2)+2(16)
= 40+32+64+4+32 = 172
ดังนั้น มวลโมเลกุลของ CaSO4 . 2H2O = 172 ตอบ
แบบที่ 2 เมื่อทราบมวลของสาร 1 โมเลกุล และมวลของธาตุมาตรฐาน 1 อะตอม
ตั ตอบ
นอกจากนี้ยังมีการหาโมเลกุลได้จากวิธีอื่น ๆ อีก เช่น หาจากโมลหรือจากกฎของอาโวกาโดร เป็นต้น
6 โมล
โมล คือ หน่วยของปริมาณสารหน่วยหนึ่งที่มีความหมายเช่นเดียวกับกรัมโมเลกุล กรัมอะตอมหรือกรัม
ไอออน มีวิธีหาได้ 4 แบบ ดังต่อไปนี้
6.1 จำนวนอนุภาคต่อโมลของสาร
สสารทุกชนิด 1 โมลมีจำนวน
6.023 x 1023 อนุภาค
(6.023 x 1023 คือเลขอาโวกาโดร)
อนุภาค คือ อะตอมโมเลกุล ไอออน อิเล็กตรอน เป็นต้น
- ธาตุ เช่น Na 1 โมล มีจำนวน 6.023 x 1023 โมเลกุล หรือ 6.023 x 1023 อะตอม
Na+ 1 โมล มีจำนวน 6.023 x 1023 ไอออน
Cl2 1 โมล มีจำนวน 6.023 x 1023 โมเลกุล หรือ 2 x 6.023 x 1023 อะตอม ( 1 โมเลกุลมี 2 อะตอม),
Cl- 1 โมล มีจำนวน 6.023 x 1023 ไอออน
- สารประกอบ เช่น SO3 1 โมล มีจำนวน 6.023 x 1023 โมเลกุล หรือ 4 x 6.023 x 1023 อะตอม
(SO3 1 โมเลกุลประกอบด้วย H 2 อะตอม S 1 อะตอม และ O 4 อะตอม รวมเป็น 7 อะตอม)
6.2 จำนวนโมลกับมวลของสาร
มวลหรือน้ำหนักของสาร 1 โมล คือมวลโมเลกุลหรือมวลอะตอม ตัวอย่างเช่น O2 1 โมล หนัก 32 กรัม
6.3 ปริมาตรต่อโมลของก๊าซ
ก๊าซทุกชนิด 1 โมล มี 22.4 ลูกบาศก์เซนติเมตรที่ STP คือที่อุณหภูมิและความดันมาตรฐาน (ที่ 0 องศาเซลเซียส
1 บรรยากาศ หรือ 273 เคลวิน 760 มิลลิเมตรของปรอท)
ตัวอย่างเช่นไอน้ำ 1 โมล มีปริมาตร 22.4 ลูกบาศก์เดซิเมตร ที่ STP
6.4 ความสัมพันธ์ระหว่างจำนวนโมล อนุภาค มวล และปริมาตร
สาร 1 โมลจะมีมวลเป็นกรัมเท่ากับมวลอะตอมและมีจำนวนอนุภาคเท่ากับ 6.023 x 1023 อนุภาค และถ้าสารนั้น
เป็นก๊าซที่ STP จะมีปริมาตรเท่ากับ 22.4 ลูกบาศก์เดซิเมตร
ตัวอย่างเช่น ไอน้ำ 18 กรัมมีปริมาตร 22.4 ลูกบาศก์เซนติเมตร ที่ STP มีจำนวนอนุภาคเท่ากับ 6.023 x 1023 อนุภาค
6.5 กฎของอาโวกาโดร
โมลของก๊าซหาได้จากกฎของอาโวกาโดร
กฎของอาโวกาโดรสรุปว่า
"ภายใต้เงื่อนไขเดียวกัน (อุณหภูมิและความดัน)
ก๊าซทุกชนิดที่มีปริมาตรเท่ากันจะมีจำนวนโมเลกุลและจำนวนโมลเท่ากัน เช่น ก๊าซออกซิเจน 1 ลูกบาศก์เดซิเมตร จะมีจำนวนโมลและโมเลกุลเท่ากับก๊าซไฮโดรเจน 1 ลูกบาศก์เดซิเมตร ที่อุณหภูมิและความดันเดียวกัน และยังเท่ากับจำนวนโมลและโมเลกุลชองก๊าซอื่น ๆ ที่มีปริมาตรเท่ากันภายใต้อุณหภูมิและความดันเดียวกัน
7 สูตรเคมีและสมการเคมี
จำนวนโมลหาได้จากกฎของเกย์-ลูสแซกและกฎของอาโวกาโดร การหาจำนวนโมลโดยวิธีนี้เป็นการหาจำนวนโมลของสมการเคมี
กฎของเกย์-ลูสแซกสรุปว่า "ปริมาตรของก๊าซที่ทำปฏิกิริยากันและที่ได้จากปฏิกิริยาจะเป็นอัตราส่วนลงตัวน้อย ๆ ที่อุณหภูมิและความดันเดียวกัน"
ลักษณะสำคัญของกฎของเกย์-ลูสแซกและกฎของอาโวกาโดร
1. จำนวนโมลและโมเลกุลของสมการเคมีจะมีค่าเท่ากับปริมาตรของก๊าซที่เข้าทำ
ปฏิกิริยาพอดีกันนั่นเอง
2. จำนวนโมลเหล่านี้คือตัวเลขที่ใช้ในการดุลสมการเคมี
เช่น 4NH3(g) +3O2(g) 2N2(g)+6H2O(g)
3. จากปริมาตรของก๊าซที่ทำปฏิกิริยาพอดีกันและที่ได้จากปฏิกิริยาที่อุณหภูมิและความดันเดียวกัน
สามารถนำไปใช้หาสูตรโมเลกุลของก๊าซได้ โดยอาศัยหลักการดุลสมการ
เคมี
4. จากสมการแสดงปฏิกิริยาเคมีของก๊าซที่ดุลแล้ว อัตราส่วนจำนวนโมลหรือจำนวนโมเลกุลจะเท่ากับอัตราส่วนโดยปริมาตรของก๊าซที่เข้าทำปฏิกิริยากันและที่ได้จากปฏิกิริยา สามารถนำไปใช้หาปริมาตรของก๊าซต่าง ๆ ในปฏิกิริยาเคมีนั้น ๆ ได้
