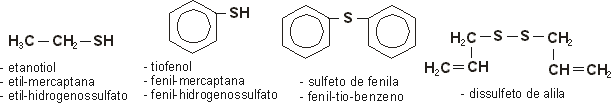
TIO-COMPOSTOS
1- Nomenclatura e exemplos
Os tio-compostos são moléculas que apresentam átomos de enxofre em sua estrutura. Em geral, eles são produzidos pela substituição dos átomos de oxigênio dos álcoois, fenóis, éteres e peróxidos, por átomos de enxofre, originando os tioálcoois (ou tióis), tiofenóis, tioéteres e dissulfetos.
Para tio-álcoois e tio-fenóis:
| Nomenclatura oficial IUPAC: | nome do hidrocarboneto + tiol |
| Nomenclatura usual I: | radical + mercaptana |
| Nomenclatura usual II: | radical + hidrogenossulfeto |
Para tio-éteres:
| Nomenclatura oficial IUPAC: | radical menor + tio + hidrocarboneto maior |
| Nomenclatura usual: | sulfeto de + radical menor + e + radical maior |
Para dissulfetos:
| Nomenclatura oficial IUPAC: | dissulfeto de + radial menor + e + radical maior |
Alguns exemplos importantes:

2- Propriedades físicas
Os tioálcoois aparecem, em pequenas quantidades, na putrefação de proteínas sulfuradas, no gás de hulha e no petróleo. Os membros mais simples são líquidos incolores, pouco solúveis em água e bastante voláteis, caracterizados por um odor penetrante e desagradável, que os torna reconhecíveis mesmo em mínimas concentrações. Os tioálcoois são muito solúveis em soluções básicas fortes, pois apresentam um caráter ácido mais forte do que os álcoois. Os pontos de ebulição dos tioálcoois são bem inferiores aos dos álcoois correspondentes, pela baixa tendência do enxofre a formar ligações de hidrogênio, enfraquecendo assim as forças intermoleculares.
Os sulfetos (tioéteres) não ocorrem na natureza e são de pequena importância. A iperita, ou gás mostarda, que é um sulfeto clorado, foi usado durante a Segunda Guerra Mundial, como gás tóxico. Os sulfetos mais simples são líquidos incolores, de cheiro etérico, insolúveis em água e solúveis em álcool, éter etc.
O dissulfeto de alila (H2C=CH-CH2-S-S-CH2-CH=CH2) é um líquido de odor penetrante, que ferve a 139o C, encontrado há muito tempo no alho. O radical -CH2-CH=CH2 recebeu, por esse motivo, o nome de alila. Os compostos em que ele aparece são ditos alílicos.
3- Métodos de obtenção
Os principais métodos de preparação dos tioálcoois são (as duas primeiras dão bons rendimentos):
Os sulfetos são preparados normalmente pelas reações:
4- Propriedades químicas
A facilidade com que os tioálcoois reagem com o óxido de mercúrio, e em geral com os metais de alta massa molecular, formando compostos cristalinos, distingue os tioálcoois dos álcoois. É dessa característica, aliás, que deriva seu nome usual (mercaptana), formado a partir da expressão "mercurius captans", ou seja, traduzindo literalmente, significa que se apodera do mercúrio". Os tioalcoolatos, ou mercaptatos, são compostos cristalinos obtidos com metais pesados, e correspondem aos alcoolatos. Entretanto, além de se formarem com mais facilidade, são mais estáveis que os alcoolatos.
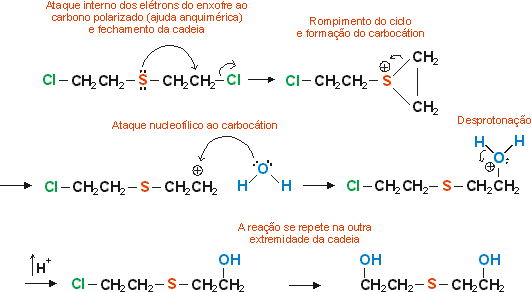
A "iperita" sofre uma reação interessante, chamada Substituição Nucleofílica Interna. Esse tipo de SN ocorre em moléculas que apresentam em sua estrutra um nucleófilo e um bom grupo abandonador. No caso da iperita, o nucleófilo é o enxofre (que possui pares eletrônicos livres) e o grupo abandonador é o cloro. A substituição do grupo abandonador por outro grupo mais estável é facilitada pela ação do nucleófilo. A essa "ajuda"dada pelo nucleófilo chamamos "ajuda anquimérica". Veja:
5- Aplicações dos tio-compostos
Dentre as mercaptanas alifáticas (tioálcoois), destaca-se o etanotiol (C2H5SH), que constitui estágio intermediário para a produção do sulfonal, que se presta à obtenção de remédios hipnóticos. Das mercaptanas aromáticas, o tiofenol (C6H5SH) é um dos membros mais importantes. A partir das mercaptanas é possível obter, por oxidação, os ácidos sulfínicos (R-SO2H) e os ácidos sulfônicos (R-SO3H). As mercaptanas, por seu forte odor penetrante, são utilizados em mistura com gases de reservatórios e tubulações, para detecção de vazamentos.
Química 2000 - Wagner Xavier Rocha, 1999