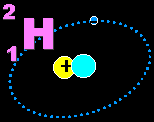
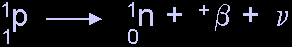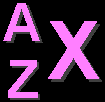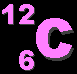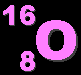ไอโซโทป
(Isotope) และไอโซโทปรังสี (Radioisotope) |
-
อนุภาคภายในนิวเคลียส ทั้งโปรตอน และนิวตรอน เรียกว่า
นิวคลีออน (nucleon)
-
จำนวนโปรตอน เรียกว่า เลขอะตอม (atomic number,
Z)
-
จำนวนนิวตรอน เรียกว่า เลขนิวตรอน (neutron number)
-
จำนวนนิวคลีออน ซึ่งเป็นผลรวมของ จำนวนโปรตอน
กับนิวตรอน เรียกว่า เลขมวล (mass number) หรือมวลอะตอม (atomic
mass, A)
-
สัญลักษณ์ทางนิวเคลียร์ แสดงด้วยสัญลักษณ์ของธาตุ
(X) เลขมวล (A) และเลขอะตอม (Z)
|
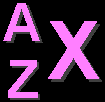

|
|
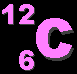
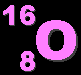
|
- ธาตุแต่ละธาตุ แตกต่างกันที่จำนวนโปรตอน หรือเลขอะตอม
- แต่ละธาตุจะมี จำนวนโปรตอน และจำนวนนิวตรอนเฉพาะเท่านั้น ที่ทำให้อยู่ในสภาวะที่เสถียร
- คาร์บอน เป็นธาตุที่มี 6 โปรตอน และมีมวลอะตอม 12 แสดงว่ามี 6
นิวตรอน
- ออกซิเจน เป็นธาตุที่มี 8 โปรตอน มีมวลอะตอม 16 แสดงว่ามี 8 นิวตรอน
|
|
- ธาตุชนิดเดียวกัน อาจมีมวลต่างกัน เนื่องจากจำนวนนิวตรอนไม่เท่ากัน
เรียกว่า เป็นไอโซโทปกัน
- ไฮโดรเจนมี 3ไอโซโทป ได้แก่ 1H, 2H
และ 3H
|
|
|
|
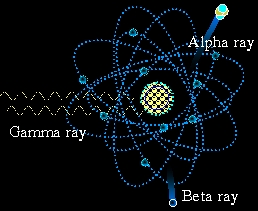 |
- ไอโซโทปในธรรมชาติ ส่วนใหญ่เป็น ไอโซโทปเสถียร (stable isotope)
- ไอโซโทปรังสี (radioisotope) เป็นไอโซโทป ที่ไม่เสถียร เนื่องจากนิวเคลียส
มีระดับพลังงานสูง
- ไอโซโทปรังสี จะปรับตัวเข้าสู่ สภาวะเสถียร โดยปลดปล่อยพลังงานออกมา
ในรูปของรังสี
- รังสีที่ปลดปล่อยออกมา อาจเป็นคลื่นแม่เหล็กไฟฟ้า เช่น รังสีแกมมา
(gamma ray) หรือเป็นอนุภาค เช่นรังสีอัลฟา (alpha ray) รังสีบีต้า
(beta ray)
|
- ถ้าจำนวนโปรตอน หรือจำนวนนิวตรอนไม่สมดุล นิวเคลียสจะไม่เสถียร ซึ่งจะปรับสภาวะให้เสถียร
โดยปลดลปล่อยรังสีออกมา
- ถ้าจำนวนนิวตรอนเกิน จะถูกเปลี่ยนเป็นโปรตอน และให้รังสีบีต้าประจุลบ
หรือเนกาตรอนออกมา
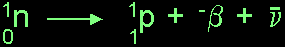
- ถ้าจำนวนโปรตอนเกิน จะถูกเปลี่ยนเป็นนิวตรอน โดยให้รังสีบีต้าประจุบวก
หรือโพสิตรอนออกมา หรืออาจจับอิเล็กตรอนวงใน ที่อยู่ใกล้ไปรวมกับนิวเคลียส
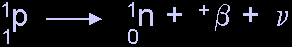
|
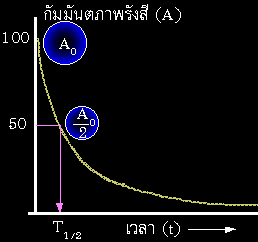
- ไอโซโทปรังสี จะมีกัมมันตภาพ (activity) ลดลงตามเวลา แบบเอ๊กโปเนนเชียล
- ตามสมการ A = A0e-lt
- ระยะเวลาที่กัมมันภาพลดลง เหลือครึ่งหนึ่ง เรียกว่า ครึ่งชีวิต
(half life) ซึ่งเป็นค่าคงที่เฉพาะ ของแต่ละไอโซโทป เช่น ออกซิเจน-19
มีครึ่งชีวิต 27 วินาที คาร์บอน-14 มีครึ่งชีวิต 5,730 ปี
|
 |
|
| |
| |
| |
| |