|
โปรตีน |
โปรตีน เป็นสารอินทรีย์ที่พบมากที่สุดในสิ่งมีชีวิต ถ้าไม่รวมน้ำอยู่ด้วย ในสิ่งมีชีวิตมีโปรตีนมากกว่าร้อยละ 50 โดยน้ำหนักโปรตีนเป็นสารประกอบประเภทอลิเมอร์ซึ่งเป็นสารที่มีขนาดใหญ่หรือมีมวลโมเลกุลมากคือประมาณ 5,000 จนถึงมากกว่า 40,000,000 ในโมเลกุลของโปรตีนประกอบด้วยหน่วยย่อยที่เรียกว่า กรดอะมิโน ซึ่งมีหลายชนิดและหลาย ๆ โมเลกุลมารวมตัวกัน
|
โปรตีน |
มวลโมเลกุล |
โปรตีน |
มวลโมเลกุล |
|
Insulin Ribonuclease Trypsin Lactalbumin Zein b -Lactoglobulin |
5,734 13,000 13,500 17,400 40,000 42,000 |
Ovallbumin Hemoglobin Serum albumin Serum g globulin Edestin Urease |
44,000 67,000 69,000 96,000 310,000 370,000 |
ตารางแสดงมวลโมเลกุลของโปรตีนบางชนิด
โปรตีนส่วนใหญ่ประกอบด้วยธาตุคาร์บอน(C) ออกซิเจน(O) ไฮโดรเจน(H) และไนโตรเจน(N) ธาตุที่พบในโปรตีนรองลงมาคือ กำมะถัน(S) และฟอสฟอรส(P) นอกจากนั้นในโปรตีนบางชนิดยังอาจมีธาตุอื่นๆ อยู่ด้วยแต่พบฝนปริมาณน้อยมาก เช่น เหล็ก ทองแดง เป็นต้น ส่วนประกอบของธาตุโดยเฉลี่ยที่พบในโปรตีนเป็นดังในตาราง
|
ธาตุ |
ร้อยละโดยมวล |
|
C O N H S P โลหะ เช่น Fe, Zn, Cu และธาตุอื่นๆ |
50-55 20-24 15-18 6-8 0.0-3.5 0.0-1.5 น้อยมาก |
ตารางแสดงส่วนประกอบของธาตุในโปรตีน
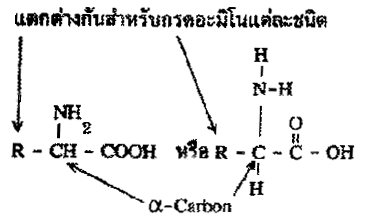
กรดอะมิโน(Amino acid)
กรดอะมิโนเป็นองค์ประกอบ(เป็นมอนอเมอร์) ของโปรตีน ที่พบมากในสิ่งมีชีวิตมีอยู่ประมาณ 20 ชนิด กรดอะมิโนแต่ละชนิดประกอบด้วยหมู่อะมิโน(-NH2) กับหมู่คาร์บอกซิล (-COOH) และหมู่แอลคิล (R) ดังนั้นกรดอะมิโนมีสูตรทั่วไปดังนี้

R อาจเป็นไฮโดรเจน ไฮโดรคาร์บอน หรืออื่นๆ ดังแสดงในตาราง กรดอะมิโนที่พบในโปรตีนจะต่างกันที่หมู่ R (หรือ Side chain) ดังนั้นกรดอะมิโนทั้ง 20 ชนิดอาจแบ่งออกได้เป็น 2 ประเภท ตามลักษณะของหมู่ R คือ (1) กรดอะมิโนที่หมู่ R ไม่มีขั้ว (2) กรดอะมิโนที่หมู่ R มีขั้ว
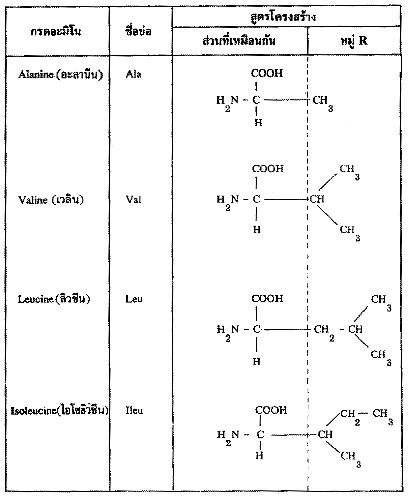
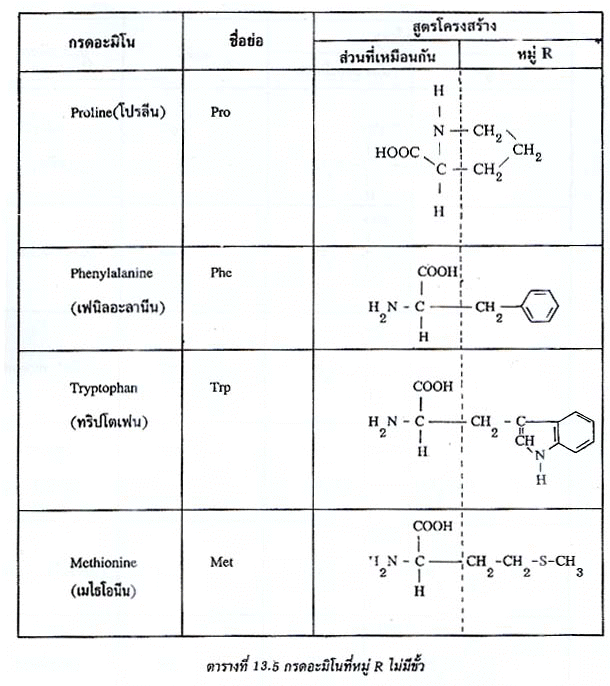
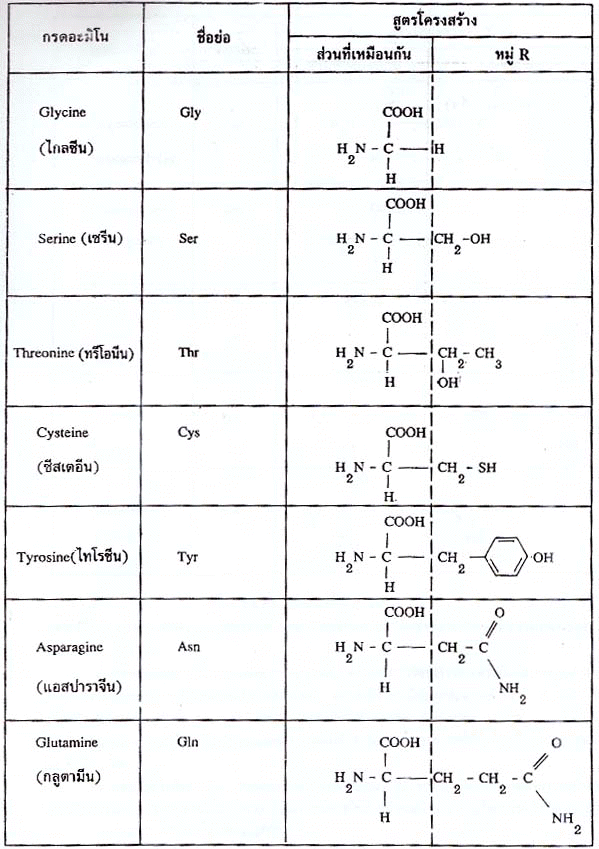
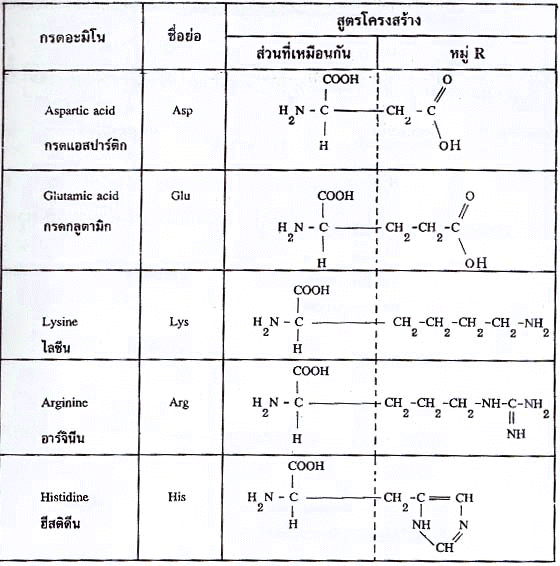
ตารางกรดอะมิโนที่หมู่ R ไม่มีขั้ว
กรดอะมิโนทั้ง 20 ชนิด ถ้าพิจารณาในแง่ของความจำเป็นต่อร่างกายของคน หรือสัตว์ชั้นสูงอื่น สามารถแบ่งออกได้เป็น 2 ประเภท คือ
1. กรดอะมิโนจำเป็น (Essential amino acids) คือ กรดอะมิโนซึ่งร่างกายสร้างไม่ได้ จำเป็นต้องได้จากอาหารที่รับประทาน หรือร่างกายสร้างได้แต่ไม่พอ กรดอะมิโนจำเป็นสำหรับมนุษย์ มีอยู่ 8 ชนิด คือ ไอโซลิวซีน(Isoleucine) ลิวซีน(Leucine) ไลซีน(Lysine) เมไทโอนีน(Methionine) เฟนิลอะลานีน(Phenylalanine) ทรีโอนีน(Threonine) ทริฟโตเฟน(Tryptophane) และเวลีน(Valine) เด็กทารกต้องการฮีสติดีน(Histidine) ด้วยจึงมี 9 ชนิด
2. กรดอะมิโนที่ไม่จำเป็น (Nonessential amino acids) คือ กรดอะมิโนที่ร่างกายสามารถสร้างได้ไม่จำเป็นต้องได้จากอาหาร กรดอะมิโนพวกนี้ได้แก่ กรดอะมิโนที่เหลือจากในข้อ 1
โครงสร้างของโปรตีน
โปรตีนทุกชนิดประกอบด้วยกรดอะมิโนมารวมตัวกันโดยกระบวนการพอลิเมอไรเซชันชนิดคอนเดนเซชันพอลิเมอไรเซชัน คือ กรดอะมิโนซึ่งเป็นมอนอเมอร์รวมตัวกันเป็นโปรตีน (พอลิเมอร์) และมีน้ำเกิดขึ้นด้วยกรดอะมิโนในโปรตีนแต่ละชนิดรวมตัวกันโดยพันธะเพปไทด์ (Peptide bond) ซึ่งเกิดขึ้นระหว่างคาร์บอนอะตอมในหมู่คาร์บอกซิลของกรดอะมิโนโมเลกุลหนึ่งกับไนโตรเจนอะตอมในหมู่อะมิโนของกรดอะมิโนอีกในโมเลกุลหนึ่ง
ประเภทของโปรตีน
ในการแบ่งประเภทของโปรตีนสามารถแบ่งได้หลายลักษณะ ทั้งนี้ขึ้นอยู่กับเกณฑ์ที่ใช้ในการแบ่ง
ก. แบ่งโดยอาศัยโครงสร้างของโมเลกุลโปรตีน สามารถแบ่งออกได้ 2 ประเภท คือ
1. โปรตีนเส้นใย (Fibrous protein) เป็นโปรตีนที่มีโครงสร้างซับซ้อนโมเลกุลมีการจัดเรียงตัวเป็นเส้นยาวหรือขดเป็นเกลียว ตัวอย่างโปรตีนเส้นใย เช่น เคราดินในเส้นผม ขนสัตว์ เขาสัตว์และเล็บไฟโบรอินในไหม ไมโอชินในกล้ามเนื้อ คอลลาเจนในเนื้อเยื่อเกี่ยวพันพบมากในสัตว์ที่มีกระดูกสันหลัง
2. โปรตีนก้อนกลม (Globular protein) เป็นโปรตีนที่มักละลายได้ในน้ำ มีสายพอลิเพปไทด์พันไปพันมาและอัดแน่น ทำให้โมเลกุลมีรูปร่างเป็นก้อนกลม ตัวอย่างโปรตีนก้อนกลม เช่น เอนไซม์, แอนติบอดี ฮอร์โมน ฮีโมโกลบิน เป็นต้น
ข. แบ่งตามหน้าที่ต่าง ๆ ของโปรตีนภายในร่างกาย สามารถแบ่งออกได้หลายชนิดดังนี้
1. โปรตีนโครงสร้าง (Structural protein) มีหน้าที่สร้างความแข็งแกร่งและป้องกันหรือยึดเหนี่ยวส่วนต่าง ๆ ไว้ในร่างกาย หลังจากเอาน้ำออกแล้วจะประกอบด้วยโปรตีนชนิดนี้มากกว่า 50% ได้แก่ คอลลาเจน ซึ่งเป็นส่วนประกอบในกระดูก เนื้อเยื่อเกี่ยวพัน เคราติน ในผม ผิวหนัง เล็บ และอีลาสตินในเส้นเลือด เป็นต้น
2. โปรตีนที่ใช้ในการหดตัว (Contractile protein) ใช้ในการออกกำลังหรือเคลื่อนไหว ได้แก่ แอคติน(Actin) และไมโอชิน(Myosin)
3. เอ็นไซม์ (Enzyme) เอ็นไซม์ทุกชนิดคือโปรตีน ทำหน้าที่เป็นตัวเร่งปฏิกิริยาภายในร่างกายตัวอย่างเช่น ทำหน้าที่เร่งปฏิกิริยาการย่อยสลายโปรตีนเป็นกรดอะมิโน แป้งเป็นน้ำตาล ไขมันและน้ำมันเป็นกรดไขมัน และกลีเซอรอล เป็นต้น ถ้าร่างกายไม่มีเอ็นไซม์ปฏิกิริยาที่เกิดภายในร่างกายจะช้า ทำให้เราไม่สามารถดำรงชีวิตอยู่ได้
4. ฮอร์โมน (Hormones) ฮอร์โมนภายในร่างกายหลายชนิดเป็นโปรตีน ซึ่งทำหน้าที่ควบคุมกระบวนการต่างๆ ทั่วร่างกาย เช่น ฮอร์โมนอินซูลินทำหน้าที่ควบคุมระดับน้ำตาลกลูโคสในเลือด เป็นต้น
5. โปรตีนขนส่ง (Transport protein) เช่น ฮีโมโกลบิน เป็นตัวขนส่งออกซิเจนจากปอดไปตามเลือดไปยังเซลล์ต่างๆ ทั่วร่างกาย ไมโอโกลบินเป็นตัวนำออกซิเจนไปส่งยังเซลล์กล้ามเนื้อ เป็นต้น
6. โปรตีนต้อนรับ (Receptor protein) โปรตีนหลายชนิดโดยเฉพาะที่เยื่อเซลล์มีหน้าที่จบกับสารบางอย่าง เช่น ตัวส่งสัญญาณทางประสาท ฮอร์โมน ตัวควบคุม เป็นต้น แล้วก่อให้เกิดการเปลี่ยนแปลงทางชีววิทยา เช่น มีการตอบสนองการกระตุ้นของฮอร์โมนได้
7. โปรตีนป้องกัน (Protective protein) อิมมูโนโกลบูลินในเลือดทำหน้าที่เป็นแอนติบอดีซึ่งจะจับกับสิ่งแปลกปลอมภายนอกที่เป็นแอนดีเจน แล้วจะถูกขับออกจากร่างกาย ไฟบรินและธรอมบินมีความสำคัญมากเกี่ยวข้องกับการแข็งตัวของหลอดเลือด เป็นต้น
8. โปรตีนสะสม (Storage protein) มีโปรตีนหลายชนิดเป็นแหล่งอาหาร เช่น เคซีนในน้ำนม โอวัลบูมินในไข่ขาว เป็นต้น
ค. แบ่งตามคุณค่าทางโภชนาการ แบ่งออกได้ 3 ชนิด คือ
1. โปรตีนประเภทสมบูรณ์ หมายถึงโปรตีนที่มีกรดอะมิโนที่จำเป็นต่อร่างกายครบทุกชนิด และมีในปริมาณสัดส่วนที่เพียงพอที่จะทำให้ร่างกายเจริญเติบโตและซ่อมแซมส่วนที่สึกหรอ โปรตีนประเภทนี้มีอยู่ในอาหารพวกน้ำนม ไข่ เนื้อสัตว์ ถั่วเหลือง
2. โปรตีนประเภทไม่สมบูรณ์ หมายถึง โปรตีนที่มีกรดอะมิโนที่จำเป็นต่อร่างกายไม่ครบทุกชนิดหรือมีกรดอะมิโนที่จำเป็นครบแต่บางชนิดมีปริมาณน้อย ไม่เหมาะสมในการสร้างโปรตีนของร่างกาย ได้แก่ โปรตีนจากพืชทุกชนิดยกเว้นถั่วเหลือง
3. โปรตีนประเภทกึ่งสมบูรณ์ หมายถึงโปรตีนที่ประกอบด้วยกรดอะมิโนจำเป็นในปริมาณเพียงพอต่อการดำรงชีวิต แต่ไม่เพียงพอสำหรับการเจริญเติบโตและซ่อมแซมส่วนที่สึกหรอของร่างกาย เช่น โปรตีนจากข้าวสาลี
สมบัติและปฏิกิริยาบางประการของโปรตีน
1. โปรตีนเมื่อผสมกับน้ำจะไม่ได้สารละลายแต่จะได้คอลลอยด์
2.ในโมเลกุลของโปรตีนนอกจากประกอบด้วยกรดอะมิโนจำนวนมากเชื่อมต่อกันเป็นสายยาวด้วยพันธะเพปไทด์แล้ว
ยังมีแรงยึดเหนี่ยวอื่นๆอีกที่ช่วยทำให้สายพอลิเพปไทด์มีโครงสร้างที่เหมาะสมต่อหน้าที่ทางชีววิทยาของโปรตีน
เช่น พันธะไฮโดรเจนซึ่งเกิดขึ้นระหว่างหมู่คาร์บอนิล![]() ของกรดอะมิโนกับหมู่อิมิโน
ของกรดอะมิโนกับหมู่อิมิโน
![]() ของกรดอะมิโนที่อยู่ถัดไป
4 โมเลกุล ทำให้สายพอลิเพปไทด์มีโครงสร้างเป็นเกลียวหรือพันธะไฮโดรเจนระหว่างหมู่คาร์บอนิล
ของกรดอะมิโนที่อยู่ถัดไป
4 โมเลกุล ทำให้สายพอลิเพปไทด์มีโครงสร้างเป็นเกลียวหรือพันธะไฮโดรเจนระหว่างหมู่คาร์บอนิล![]() ของพอลิเพปไทด์สายหนึ่งกับหมู่อิมิโน
ของพอลิเพปไทด์สายหนึ่งกับหมู่อิมิโน![]() ของพอลิเพปไทด์อีกสายหนึ่ง
ทำให้เกิดโครงสร้างเป็นแผ่น หรือแรงยึดเหนี่ยวต่างๆ เช่น พันธะไฮโดรเจน พันธะไดซัลไฟด์
แรงแวนเดอร์วาลส์ที่ช่วยทำให้สายพอลิเพปไทด์เกิดการขดตัวเป็นโปรตีนลักษณะก้อนกลม
แรงยึดเหนี่ยวต่างๆ ดังกล่าวนอกจากเกิดระหว่างหมู่คาร์บอนิลและหมู่อิมิโนที่พันธะเพปไทด์แล้ว
ยังเกิดขึ้นระหว่างหมู่คาร์บอนิลและหมู่อิมิโนที่พันธะเพปไทด์แล้ว ยังเกิดขึ้นระหว่างหมู่แอลคิล
(R) ได้อีกด้วย
ของพอลิเพปไทด์อีกสายหนึ่ง
ทำให้เกิดโครงสร้างเป็นแผ่น หรือแรงยึดเหนี่ยวต่างๆ เช่น พันธะไฮโดรเจน พันธะไดซัลไฟด์
แรงแวนเดอร์วาลส์ที่ช่วยทำให้สายพอลิเพปไทด์เกิดการขดตัวเป็นโปรตีนลักษณะก้อนกลม
แรงยึดเหนี่ยวต่างๆ ดังกล่าวนอกจากเกิดระหว่างหมู่คาร์บอนิลและหมู่อิมิโนที่พันธะเพปไทด์แล้ว
ยังเกิดขึ้นระหว่างหมู่คาร์บอนิลและหมู่อิมิโนที่พันธะเพปไทด์แล้ว ยังเกิดขึ้นระหว่างหมู่แอลคิล
(R) ได้อีกด้วย
เนื่องจากแรงต่างๆ ส่วนใหญ่เป็นแรงที่อ่อน
ถูกทำลายได้ง่าย ดังนั้นเมื่อโปรตีนถูกกับความร้อน รังสีเอกซ์ รังสีอัลตราไวโอเลต
สารเคมีบางชนิด เช่น กรด เบส แอลกอฮอล์ ไอออนของโลหะหนัก แรงยึดเหนี่ยวเหล่านั้นจะถูกทำลาย
ทำให้โปรตีนเสียสภาพธรรมชาติ ซึ่งเรียกว่า การแปลงสภาพโปรตีน (Denatured
protein) โปรตีนที่เกิดการแปลงสภาพอาจทำให้ไม่สามารถทำหน้าที่ทางชีวภาพได้เช่น
ถ้าโปรตีนนั้นเป็นเอนไซม์ จะเสียความสามารถในการเร่งปฏิกิริยา เป็นต้น นอกจากนั้นโปรตีนที่เกิดการแปลงสภาพมักจะเกิดการแข็งตัวและไม่ละลายน้ำ
หรือทำให้โปรตีนเกิดการตกตะกอนโปรตีนที่เกิดการแปลงสภาพอาจทำให้มีผลดีทางโภชนาการคือ
ทำให้ย่อยได้ง่ายขึ้น นอกจากนี้ยังช่วยทำให้พิษของโปรตีนบางชนิดหมดไป อย่างไรก็ตามโปรตีนที่เกิดการแปลงสภาพไปแล้ว
อาจกลับสู่สภาพปกติได้อีก เมื่อปรับ
สิ่งแวดล้อมให้เหมือนเดิม
ตัวอย่างการแปลงสภาพของโปรตีน ได้แก่
1. การต้มไข่ ลวงไข่ การทำลายแบคทีเรียในอาหารด้วยความร้อน ความร้อนที่ 50 C ทำให้โปรตีนเกิดการแปลงสภาพ
2. ในสภาวะที่เป็นกรดโปรตีนมีประจุสุทธิเป็นบวก ไอออนลบของกรดที่เป็นไอออนเชิงซ้อนจะจับกับโปรตีนด้วยแรงดึงดูดทางไฟฟ้า ทำให้โมเลกุลของโปรตีนรวมตัวกันและตกตะกอนดังนั้นเมื่อกรดเข้าตา จะทำให้เกิดการแปลงสภาพของโปรตีนในดวงตา ซึ่งอาจทำให้ตาบอดได้
3. ตัวทำละลายอินทรีย์ เช่น แอลกอฮอล์ จะเกิพันธะไฮโดรเจนกับโปรตีน ทำให้โปรตีนละลายน้ำได้น้อยลง และตกตะกอน หลักการนี้ได้นำไปใช้ในชีวิตประจำวัน เช่น การใช้แอลกอฮอล์เข้มข้นร้อยละ 70 โดยปริมาตรฆ่าเชื้อโรค
4. ในสภาพที่มีไอออนของโลหะหนัก เช่น Pb2+ Hg2+ Ag+ Cd2+ ไอออนเหล่านี้จะจับกับประจุลบของโมเลกุลโปรตีน เกิดเกลือคาร์บอกซีเลต ทำให้โปรตีนตกตะกอน และเกิดได้ดีที่สภาพเป็นกลาง และเป็นเบสเล็กน้อย การแปลงสภาพของโปรตีนโดยวิธีนี้ได้มีการนำไปใช้ใช้ประโยชน์ทางด้านการแพทย์ คือล้างท้องคนไข้ที่รับประทานยาพิษพวกไอออนของโลหะหนัก โดยให้กินไข่ขาวดิบ ไอออนของโลหะหนักจะรวมตัวกับไข่ขาวดิบเกิดการแปลงสภาพ แล้วทำให้อาเจียนออกมา
3. โปรตีนจะตกตะกออนถ้าเติมสารสะลายเกลือบางชนิดที่มีความเข้มข้นสูง เช่น เกลือแอมโมเนียมซัลเฟต ((NH4)2SO4) เพราะไอออนของเกลือไปแย่งโมเลกุลของน้ำจากโปรตีน ทำให้โปรตีนละลายน้ำไม่ได้ การตกตะกอนวิธีนี้ไม่ได้เกิดการแปลงสภาพ
4. เมื่อเผาโปรตีน เช่น เผาเนื้อ เส้นผม เขาสัตว์ เล็บ จะมีกลิ่นเหม็น
5. โปรตีนแต่ละชนิดจะมีค่า pH คงที่ค่าหนึ่งที่ทำให้มีประจุไฟฟ้าสุทธิเป็นศูนย์ ค่า pH นี้เรียกว่า Isoelectric point ซึ่งเป็น pH ที่โปรตีนแต่ละชนิดละลายน้ำได้น้อยที่สุด หรือตกตะกอน และ pH นี้ขึ้นอยู่กับชนิดของโปรตีน
6. โปรตีนเมื่อเกิดไฮโดรลิซิสอย่างสมบูรณ์ โดยมีกรดหรือเอนไซม์เป็นตัวเร่งปฏิกิริยาจะได้กรดอะมิโนหลายชนิด ซึ่งขึ้นอยู่กับชนิดของโปรตีน
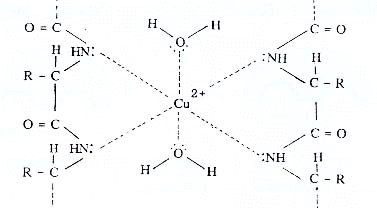
7. โปรตีนทุกชนิด เมื่อทำปฏิกิริยากับ CuSO4 ในสารละลายที่เป็นเบส เช่น สารละลาย โซเดียมไฮดรอกไซด์ (NaOH) (สารละลายนี้เรียกว่า สารละลายไบยูเรต) จะได้สารที่มีสีม่วง หรือสีน้ำเงิน ซึ่งเป็นสารประกอบเชิงซ้อนของทองแดง ส่วนกรดอะมิโนไม่เกิดปฏิกิริยานี้ เพราะเป็นปฏิกิริยาระหว่างพันธะเพปไทด์กับ Cu2+ ไอออน การทดสอบโปรตีน โดยวิธีนี้เรียกว่าการทดสอบไบยูเรต (Biuret test)
ข้อแนะนำเพิ่มเติม สารที่จะทำปฏิกิริยากับสารละลายไบยูเร็ตแล้วเกิดสารสีม่วงหรือสีน้ำเงิน จะต้องมีพันธะเพปไทด์อย่างน้อย 2 พันธะขึ้นไป โปรตีนหรือพอลิเพปไทด์จึงเกิดปฏิกิริยานี้ เพราะมีพันธะเพปไทด์มากกว่า 2 พันธะ สารสีม่วงหรือสีน้ำเงินที่เกิดขึ้นเป็นสารประกอบเชิงซ้อนของ Cu2+ ดังรูป
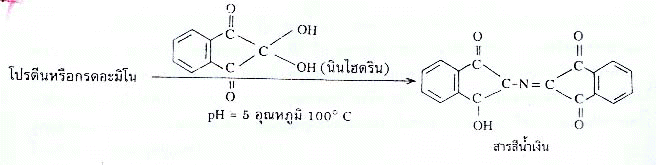
8. โปรตีนหรือกรดอะมิโน เมื่อต้มกับสารละลายนิไฮดริน (Ninhydrin solution) จะเกิดปฏิกิริยาได้สารสีชมพู ม่วงหรือน้ำเงิน ขึ้นอยู่กับชนิดของโปรตีนนั้น วิธีนี้ใช้ทดสอบโปรตีนและกรดอะมิโน
เมื่อเรารับประทานอาหารประเภทโปรตีน โปรตีนจะถูกย่อยโดยเอนไซม์เพปซินในกระเพาะอาหารเอ็นไซม์ทริปซิน และไคโมทริปซินจากตับอ่อน (เกิดปฏิกิริยาไฮโดรลิซีส โดยมีเอนไซม์เป็นตัวเร่งปฏิกิริยา) ได้พอลิเพปไทด์เล็ก ๆ และกรดอะมิโนจำนวนหนึ่ง และเพปไทด์เล็กๆ จะถูกย่อยโดยเอนไซม์คาร์บอกซีเพปติเดสจากตับอ่อน เอ็นไซม์อะมิโนเพปติเดส และไดเพปติเดสจากลำไส้ได้กรดอะมิโนอิสระ กรดอะมิโนที่ได้จะถูกดูดซึมเข้าสู่ร่างกาย กรดอะมิโนส่วนใหญ่ที่ได้จากอาหาร (ประมาณสามในสี่ส่วน) จะใช้ในการสังเคราะห์โปรตีนชนิดต่างๆ ภายในเซลล์ เช่น เอ็นไซม์ ฮอร์โมน ฮีโมโกลบิน โปรตีนโครงสร้าง เป็นต้น ส่วนกรดอะมิโนอีกส่วนหนึ่งจะถูกใช้ในการเผาผลาญเพื่อให้พลังงาน โดยทั่วไปสิ่งมีชีวิตจะใช้กรดอะมิโนเป็นแหล่งพลังงานเมื่อขาดแคลนแหล่งของพลังงานที่สำคัญคือคาร์โบไฮเดรต และไขมัน
เอนไซม์ (Enzyme)
เอนไซม์เป็นสารโปรตีนหรือพอลิเพปไทด์ที่ม้วนเป็นก้อน เอนไซม์บางชนิดประกอบด้วยพอลิเพปไทด์เพียงสายเดียว บางชนิดประกอบด้วยพอลิเพปไทด์หลายสาย และมักมีไอออนของโลหะหรือโมเลกุลที่ไม่ใช่โปรตีนอยู่ด้วย เอนไซม์อาจมีมวลโมเลกุล 10,000 ถึงมากกว่า 1 ล้านและมีสมบัติเป็นตัวเร่งปฏิกิริยาหรือคะตะลิสต์คือเอนไซม์ช่วยลดพลังงานก่อกัมมันต์ทำให้ปฏิกิริยาเกิดเร็วขึ้น เช่น การสลายไฮโดรเจนเปอร์ออกไซด์ 1 โมล ให้เป็นน้ำและออกซิเจนมีพลังงานก่อกัมมันต์ 72.4 kJ ถ้ามีเหล็กเป็นตัวเร่ง จะมีพลังงานก่อกัมมันต์ 54.34 kJ แต่ถ้าใช้เอนไซม์คะตะเลสจากตับ พลังงานก่อกัมมันต์จะลดลงเหลือเพียง 20.9 kJ
การทำงานของเอนไซม์ เอนไซม์เร่งปฏิกิริยาให้เร็วขึ้นโดยเอนไซม์จับกับสารตั้งต้นที่เรียกว่า สับสเตรต กลายเป็นสารเชิงซ้อนที่เรียกว่า เอนไซม์กับสเตรตคอมเพล็กซ์ ทำให้มีการแปรสภาพของสับสเตรต เช่น มีการสลายพันธะ หรือมีการสร้างพันธะของสับสเตรตขึ้นมาใหม่ แล้วเกิดสารผลิตภัณฑ์ขึ้น โดยที่โครงสร้างของเอนไซม์ไม่เปลี่ยนแปลง บริเวณของเอนไซม์ที่จับกับสับสเตรตเรียกว่า บริเวณเร่ง (Active site)
เอ็นไซม์ + สับสเตรต เ เอ็นไซม์สับสเตรตคอมเพล็กซ์ เ เอนไซม์ + ผลิตภันฑ์
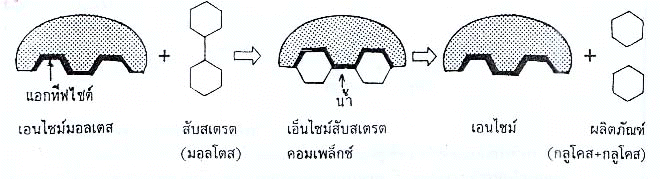
รูปแสดงการทำงานของเอนไซม์ ตามแบบจำลองแม่กุญแจกับลูกกุญแจ
เอนไซม์เร่งปฏิกิริยาได้บางปฏิกิริยาเท่านั้น แสดงว่าการทำงานของเอนไซม์มีความจำเพาะ
ในปีพ.ศ.1894 อีมิล ฟิเชอร์ ได้เสนอแนวความคิด เพื่ออธิบายการทำงานของเอนไซม์ที่เรียกว่า
แบบจำลองแม่กุญแจกับลูกกุญแจ โดยเอนไซม์เปรียบเสมือนลูกกุญแจและ
สับสเตรตเปรียบเสมือนแม่กุญแจ ซึ่งจะเกิดการเปลี่ยนแปลง เมื่อไขด้วยลูกกุญแจ และลูกกุญแจจะต้องมีโครงสร้างที่เข้ากันได้กับแม่กุญแจจึงจะใช้ไขกันได้ลูกกุญแจแต่ละดอก
จะไม่สามารถไขแม่กุญแจได้ทุกชนิด นอกจากนี้ลูกกุญแจยังสามารถไขแม่กุญแจได้หลายครั้งโดยที่
โครงสร้างของลูกกุญแจไม่เปลี่ยนแปลง
เนื่องจากเอนไซม์เป็นก้อนโปรตีนที่ยืดหยุ่นได้ไม่อยู่ตัวเหมือนลูกกุญแจ จึงได้มีผู้เสนอให้ปรับปรุงแนวความคิดแบบจำลองแม่กุญแจกับลูกกุญแจดังนี้ ขณะที่มีการรวมตัวกับสับสเตรต เอนไซม์อาจมีการเปลี่ยนแปลงรูปร่างไปบ้าง ทำให้เอนไซม์จับกับสับสเตรตได้กระชับขึ้น
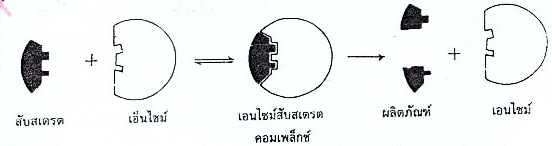
รูปแสดงการทำงานของเอนไซม์ เมือเอ็นไซม์เปลี่ยนแปลงรูปร้าง
ตัวอย่างเอนไซม์ เช่น โบรเมเลนในสับปะรด ปาเปนในยางมะละกอ เอนไซม์ทั้งสองชนิดนี้ช่วยสลายพันธะเพปไทด์ในโมเลกุลโปรตีน จึงทำให้เนื้อเปื่อยยุ่ยได้ ในยีสต์มีเอนไซม์ที่ช่วยเร่งปฏิกิริยาไฮโดรลิซิสของน้ำตาลทรายให้กลายเป็นกลูโคสกับฟรุกโตส
เอนไซม์จำนวนมากมีชื่อเรียกตามสับสเตรตของเอนไซม์โดยลงท้าย เ_ส เช่น
เอนไซม์ที่เร่งปฏิกิริยาแยกสลายยูเรียด้วยน้ำ ได้ผลิตภัณฑ์เป็นแอมโมเนียและคาร์บอนไดออกไซด์ มีชื่อเรียกว่ายูรีเอสปฏิกิริยาเกิดดังนี้
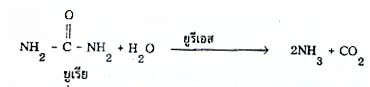
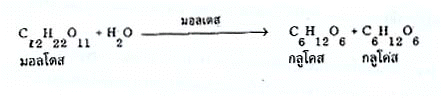
เอนไซม์ที่เร่งปฏิกิริยาการแยกสลายน้ำตาลมอลโตสด้วยน้ำ ได้น้ำตาลกลูโคส 2 โมเลกุลมีชื่อเรียกว่า มอลเตส ปฏิกิริยาเกิดดังนี้
ปัจจัยที่มีผลต่อการทำงานของเอนไซม์
1. อุณหภูมิ อัตราการทำงานของเอนไซม์จะเพิ่มขึ้นเมื่ออุณหภูมิสูงขึ้น จนถึงระดับหนึ่งการทำงานของเอนไซม์จะมีอัตราการทำงานสูงสุด แต่เมื่ออุณหภูมิสูงกว่านี้อัตราการทำงานกลับลดลง เพราะมีการเปลี่ยนแปลงรูปร่างของโปรตีนที่เป็นองค์ประกอบของเอนไซม์ อุณหภูมิที่เหมาะสมต่อเอนไซม์ทั่วไปประมาณ 25-40 C
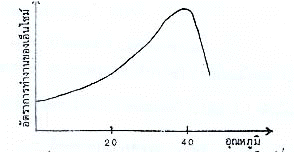
รูปกราฟแสดงอัตราการทำงานของเอนไซม์ที่อุณหภูมิต่าง ๆ
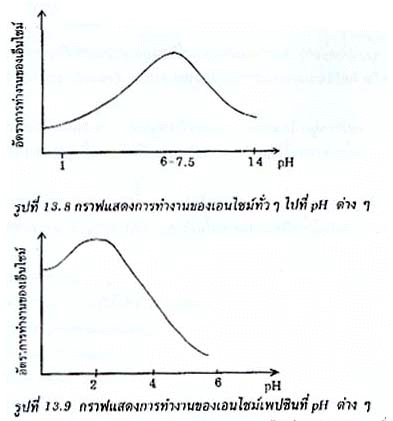
2. ความเป็นกรด-เบสหรือ pH pH มีผลต่อการทำงานของเอนไซม์ เพราะเอนไซม์จะคงสภาพอยู่ได้ในช่วง pH ที่จำกัดเท่านั้น เอนไซม์โดยทั่วไปทำงานได้ดีที่ pH ประมาณ 6-7.5 ยกเว้นเพปซินทำงานได้ดีที่ pH ประมาณ 2
3. ปริมาณของเอนไซม์และสับสเตรต ถ้าปริมาณของเอนไซม์และสับสเตรตเพิ่มขึ้น ปฏิกิริยาจะเกิดเร็วขึ้น ในทางตรงกันข้ามหากมีปริมาณลดลง ปฏิกิริยาจะเกิดช้าลง แต่ถ้าเพิ่มเฉพาะปริมาณของสับเสตรตขึ้นเรื่อยๆ ส่วนปริมาณของเอนไซม์ไม่เพิ่ม อัตราการเกิดปฏิกิริยาจะเพิ่มขึ้นจนถึงระดับหนึ่ง อัตราของปฏิกิริยาจะคงที่
4. ตัวยับยั้งเอนไซม์ โดยทั่วไปสารยับยั้งการทำงานของเอนไซม์มักมีรูปร่างโมเลกุลคล้ายกับสับสเตรต ดังนั้นสารยับยั้งเอนไซม์จึงสามารถแย่งสับสเตรตจับที่บริเวณเร่ง(Active site) ของเอนไซม์ได้ ทำให้สับสเตรตจับกับเอนไซม์ได้น้อยลง ปฏิกิริยาจึงเกิดช้าลง
5. โคแฟกเตอร์ เอนไซม์หลายชนิดจะทำงานได้ดีต้องมีตัวร่วมในการทำงาน โคแฟกเตอร์อาจจะเป็นไอออนของโลหะ เช่น Zn2+ Mg2+ Cu2+ หรืออาจเป็นสารอื่นๆ ซึ่งถ้าเป็นสารอินทรีย์ มักจะเรียกว่า ตัวร่วมเอนไซม์หรือโคเอนไซม์ เช่น NAD+ FAD+