CH3COOH
 CH3COO- + H+
CH3COO- + H+
注意:このページには数字がたくさん出てきます。こういう場合は、ただ読むだけでは分かり難いので、ノートにメモしながら読むと、理解し易いですよ。
酢酸は弱酸ですね。
ですから、その平衡状態は、
CH3COOH
 CH3COO- + H+
CH3COO- + H+
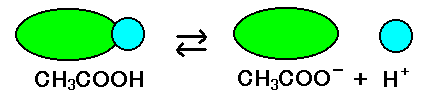
で、電離度のところでも述べました通り、水中にある 酢酸分子のほとんどは、電離していません。
具体的には、状況次第なんですけど、溶けている酢酸分子の9割近くは CH3COOH の形で存在しているんです。
では、その塩である酢酸ナトリウム CH3COONa水溶液ではどうでしょうか?
これも平衡状態で存在しまして、
CH3COONa
 CH3COO- + Na+
CH3COO- + Na+
つまりほぼ全ての分子は、 CH3COO- と Na+ の形に分かれて存在しまして、 CH3COONa と、結合しているものは、まあ、ほとんど在りません。
さて、この「弱酸」と「弱酸の塩」をほぼ等しい濃度で含む水溶液 は、おもしろい性質を示します。
例えば、酢酸を濃度 0.10 mol/l で含み、酢酸ナトリウムも同じく 0.10 mol/l で含む、酢酸-酢酸 ナトリウム水溶液を考えてみましょう。

さて、この水溶液 1 リットル中には、どの分子が何mol含まれているのでしょうか?
酢酸はほとんど電離しませんから、CH3COOH分子は、ほぼ 0.1 mol 溶けています。電離度を 0.1としても、0.09 mol 溶けている訳ですから、ま、ほぼ 0.1 mol ですね。だから、PH = 2です。
そういう訳ですから、H+は、零ではありませんが、そんなに溶けていません。
。電離度を0.1とすれば、0.01 mol だけ溶けている訳です。
一方で酢酸ナトリウムは、ほぼ100%電離していますので、 CH3COONa は、ほぼ 0 mol です。
その結果、 CH3COO- と Na+ は、0.10 mol 溶けている事になる訳です。
さて、この混合溶液の特徴は、 塩酸を加えてみると分かります。
塩酸 0.01mol を加えてみましょう。
塩酸の電離度 はほぼ 100% ですから、H+ = 0.01 mol だけ増えて、最初のH+と合わせて、[H+] = 0.02 になりそうですが、そうはならないんですよ。
だって、水溶液中には酢酸ナトリウムから生じた、 CH3COO- が 0.01 mol 在るわけでしょ?
酢酸は弱酸ですから、入ってきたH+が 、もともと居た CH3COO-と電離 したまま共存できる訳が無いんですね。
ですから入ってきたH+の0.01 mol のほとんどは、もともと居た CH3COO- と合体して、 CH3COOH になります。ですから加えたH + はほとんど残りません。例えば、9割が CH3COOHになったとしたら、H+の増加は、0.001 mol だけになるんです。
そうすると、[H+] = 0.011 になりますね。 これは PH =1.96 です。 ね、ほとんど変化していないでしょ?
じゃ、逆に、この混合液に、水酸化ナトリウムを加えた場合を考えてみましょう。
水酸化ナトリウム 0.01 mol を 加えてみたら、どうなるでしょう?
水酸化ナトリウムは強塩基ですから、塩酸同様、ほぼ 100% 電離しているので、Na+ と OH- が 0.01 mol ある訳ですね。 OH- が0.01 mol あるけれど、もともと酢酸出身のH+が 0.01 mol ありますから、中和して OH- と H+ は水になって無くなりそうですね。
 H2O
H2O
それは、確かにその通りです。
でも、だからと言って、H+の濃度は零にはなりません。
H+は、いったん無くなっても、まだ CH3COOH が 0.09 mol ある訳でしょ?
なら、H+が無くなれば、(平衡移動して) CH3COOH が電離して、新たに CH3COO- H+ が生じますすね。
電離度 0.1 ですから、大体 0.009 mol 位の H+が供給されます。ということは PH = 2.06 です。ほとんど変化してませんね。
つまり、酢酸-酢酸 ナトリウム水溶液は 、酸を加えても、塩基を加えても、PHはほとんど変わらないのですね。
この様に、弱酸と弱酸の塩の混合液は、PHの変化が起き難い性質があります。このような水溶液を「緩衝溶液」と言いまして、PHが起きては困る実験をする場合に利用します。 生物 - 化学 選択者の人は、ホモジェネライズの時に使用しましたよね?