Ataxia de Friedreich, 5 Anos Depois: Melhor Compreensão, Novas Esperanças
Pierre Rustin, PhD, Paris
(publicado em Euro-Ataxia/Newsletter - outubro/2002)
Provavelmente é a hora certa (e o lugar certo) de atualizar informações - para os pacientes de ataxia de Friedreich e seus médicos - sobre os recentes progressos realizados nas pesquisas que tratam desta doença. Para pacientes, principalmente porque um melhor entendimento dos mecanismos inerentes da doença deve resultar em novas esperanças terapêuticas; para os médicos, porque uma terapia inicial está agora disponível e deve ser proposta o mais cedo possível para cada paciente.
A idéia deste artigo é primeiro descrever - esperamos com palavras simples e esquemas - como nós entendemos (ou pensamos entender) a ataxia de Friedreich. Em seguida, resumimos os dados atuais obtidos com o uso de idebenone em vários experimentos levados a cabo em diversos países. Então, concluiremos com o relato de novos recursos agora disponíveis para conduzir futuramente (esperamos que o mais rápido possível) progressos em nosso combate à doença.
I. Primeiro, um pouco de genética…
A descoberta em 1996 do gene responsável pela ataxia de Friedreich, denominado gene frataxina, foi uma real inovação na pesquisa da doença. Mas primeiro, você deve lembrar o que é um gene. Há milhares de genes (aproximadamente 40.000) no núcleo de cada célula que, todas juntas, constituem o corpo humano. Cada gene está presente em duas cópias por célula, uma herdada da mãe e outra do pai. Em um exame mais profundo, um gene consiste em milhares de quatro componentes básicos - as famosas bases A, T, G e C -, a precisa seqüência que contém uma determinada mensagem. Estas muitas mensagens são necessárias para a célula fabricar seus vários componentes.
A anormalidade do gene observada na maioria dos pacientes com a doença consiste em uma longa repetição de uma seqüência de três letras (repetição GAA), que embaraça a leitura normal da mensagem deste gene. Esta expansão repetida da seqüência está presente em uma cópia do gene em cerca de 1 em cada 90 pessoas, mas duas cópias anormais são necessárias para desenvolver a doença. Tal condição é chamada de doença recessiva (doenças dominantes são aquelas que ocorrem mesmo quando somente uma cópia de um gene for anormal). Em outras palavras, se duas pessoas, cada uma tendo uma cópia desta expansão longa no gene frataxina, tiverem um filho, existe uma probabilidade de 25% de que a criança receba duas cópias deste gene anormal e contraia a doença. Note que a probabilidade fica inalterada para cada novo bebê, independentemente da condição dos outros filhos. Porém, a possibilidade de examinar os genes do feto permite agora um diagnóstico pré-natal desta condição para a família.
A respeito de genética, uma última observação: a mensagem contida no gene frataxina é necessária para produzir frataxina, uma das proteínas da célula. Há vários tipos de proteínas em uma célula, mas algumas delas, inclusive frataxina, podem ser comparadas a trabalhadores em uma cidade: eles constroem, transformam e consertam a célula durante sua vida. Nas células dos pacientes de ataxia de Friedreich não há suficiente frataxina (devido à dificuldade para ler a mensagem do gene) e, como resultado, a função da frataxina é pobremente assegurada, e alguns tipos de células, neurônios e células do coração em particular, não gostam nada disso. Mas qual é a função da frataxina?
II. Como funciona a frataxina, de acordo com a nossa concepção?
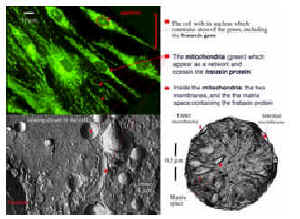
Assim que o gene de frataxina foi identificado como responsável da doença, vários laboratórios tentaram entender a função da frataxina. A questão inicial era saber onde ficava situada a frataxina na célula. Todos os estudos levados a cabo neste ponto concluem que esta proteína é encontrada essencialmente na mitocôndria e que esta não funciona corretamente quando a frataxina for baixa ou ausente em uma célula. Então, a ataxia de Friedreich é uma das numerosas doenças mitocondriais conhecidas em seres humanos. Novamente, precisamos parar um pouco aqui para recordar o que são mitocôndrias (Figura 1). Basicamente, há mitocôndrias em todas as células humanas. Elas podem ser comparadas às centrais de energia - inclusive a rede de alta voltagem – de uma cidade. Elas são o lugar onde os alimentos (açúcar, lipídios, etc), tendo sido anteriormente quebrados em pedaços pequenos, são queimados para produzir a energia que é necessária para construir e manter as células. Esta é a tarefa principal da mitocôndria, uma tarefa bastante perigosa. Realmente, se qualquer comparação deve ser feita com centrais de energia, tem que ser com o seu núcleo! Por que perigosa? Porque as mitocôndrias necessitam de oxigênio (como o fogo) para queimar os derivados de alimentos e, se o processo ficar descontrolado, serão desviadas partes da energia para produzir componentes muitos reativos, as chamadas espécies reativas de oxigênio que podem destruir vários componentes celulares e mitocondriais. As mitocôndrias não são somente locais de produção de energia. Elas também são os locais onde numerosos componentes úteis às células são fabricados, transformados e exportados a outros compartimentos da célula. Então, quando a função mitocondrial é afetada, há um problema potencial na produção de energia, e/ou na superprodução de espécies reativas de oxigênio, e/ou na produção de componentes diferentes dos necessários à célula. Com isto em mente, você provavelmente sabe o suficiente sobre mitocôndrias, assim passemos ao próximo passo.
Depois que o gene frataxina foi descoberto, os cientistas examinaram as células que foram artificialmente esvaziadas de frataxina (de fato, as células usadas eram de fermento de pão). Eles observaram uma acumulação bastante significativa de ferro na mitocôndria, às custas de ferro encontrado em outros lugares da célula. Então, a hipótese mais óbvia foi formulada: a proteína frataxina está, de uma forma ou de outra, envolvida na regulagem do transporte de ferro na (ou fora da) mitocôndria.
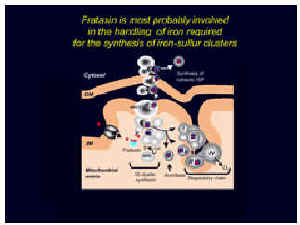
Ao mesmo tempo, descobrimos que um subtipo particular de proteínas era defeituoso em células do coração de pacientes. Este tipo de defeito nunca tinha sido antes observado em qualquer outra doença. Então, é bastante específico da ataxia de Friedreich. Estas proteínas de ferro-enxofre são muito importantes tanto para a mitocôndria, pois várias delas estão envolvidas no sistema de produção de energia mitocondrial e para o resto da célula, porque uma destas proteínas controla a entrada de ferro para a própria célula (Figura 2). Como o nome indica, as proteínas de ferro-enxofre também contêm ferro. Assim, o ferro parece desempenhar um papel fundamental na doença.
O ferro torna-se enferrujado na presença de oxigênio (e lembre-se que o oxigênio está presente e é consumido na mitocôndria). Por conseguinte, pode ser bastante perigoso se é acumulado em algum lugar da célula, por exemplo na mitocôndria. Realmente, a reação ferruginosa é acompanhada pela formação de espécies reativas de oxigênio, mencionadas acima como subprodutos perigosos do funcionamento mitocondrial. É por isso que mais ferro pode significar mais espécies reativas de oxigênio e um problema perigoso para a célula.
Voltemos agora a 1997, um ano após a descoberta do gene. Havia três hipóteses. A primeira supunha que a frataxina poderia ser requerida para a síntese das proteínas de ferro-enxofre. Isto respondia melhor pelo defeito específico destas proteínas observadas nas células do coração de pacientes. A segunda indicava que a frataxina poderia estar envolvida no transporte de ferro na (ou fora da) mitocôndria, o que se ajustava bem com a observação de acumulação de ferro na mitocôndria quando nenhuma frataxina estava presente. A terceira dizia que a frataxina poderia ser um fator controlador de espécies reativas de oxigênio (podendo destruir as proteínas de ferro-enxofre muito sensíveis) produzidas pela mitocôndria. O ferro liberado seria acumulado na mitocôndria. Realmente, estas três hipóteses poderiam ser associadas para formar um tipo de círculo vicioso como o descrito no esquema (Figura 3).
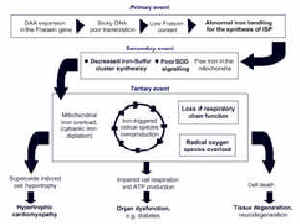
Não é necessário entrar em mais detalhes, mas no momento parece que a primeira hipótese é a correta. A frataxina pode estar envolvida principalmente na síntese da proteína ferro-enxofre e todas as outras anormalidades seriam conseqüência disso. Como resultado, a doença é uma doença de multi-passo (Figura 4). Começa com uma baixa atividade da proteína de ferro-enxofre, resultando na diminuição da produção de energia pela mitocôndria. A progressão da doença provoca a ativação do círculo de reação descrito acima, com mais ferro sendo lentamente deslocado da célula para sua mitocôndria. Estas podem então tentar desesperadamente produzir as proteínas de ferro-enxofre perdidas bombeando mais ferro. As conseqüências de ativar este círculo vicioso de reações podem ser numerosas e variáveis, porque muitos fatores (alimento, ambiente) podem afetar estas reações. Além disso, observamos recentemente que o funcionamento da proteína de ferro-enxofre danificada também afeta a habilidade das células para se protegerem de espécies reativas de oxigênio. Isto tende a aumentar as conseqüências da superprodução de radicais livres pela mitocôndria.
III. Urgente: Proteção contra radicais livres de oxigênio com idebenone
A melhor terapia da doença seria obviamente produzir mais frataxina nas células dos pacientes. Para alcançar tal objetivo, há diferentes possibilidades. Primeiro, a solução ideal seria substituir uma das duas cópias do gene frataxina, introduzindo uma cópia boa, uma abordagem conhecida como terapia gênica. Numerosos laboratórios trabalham nesta abordagem para muitas doenças. Mas ainda há numerosos problemas a serem resolvidos. Uma das maiores dificuldades é encontrar um modo de enviar o gene para todas as células; uma segunda é assegurar a estabilidade do gene depois de enviá-lo. Infelizmente, uma longa lista de problemas poderia ser enumerada. Assistimos cuidadosamente todo o progresso realizado com estes problemas, mas temos honestamente de admitir que o avanço tem sido bastante lento. Além disso, é difícil predizer quando, e também se, este tipo de aproximação terá êxito em um tipo de doença onde muitas células remotas têm que ser tratadas antes que algum efeito possa ser visto. Afirmei no início que na maioria dos casos de ataxia de Friedreich uma longa repetição de uma seqüência de GAA no gene causa dificuldades para ler o gene corretamente, como se ele estivesse dobrado e aderente devido às interações impróprias das seqüências anormalmente longas. Então, cientistas de diferentes laboratórios tentaram verificar se poderia haver um modo de as células lerem melhor este gene alterado. Se por acaso uma solução pudesse ser encontrada para habilitar o desdobramento parcial do gene anormal, mesmo que não totalmente eficiente, poderia resolver uma parte do problema. Entretanto, mesmo se houver tal solução em tubo de ensaio, ninguém sabe como fazer este trabalho nas células do organismo. Esperançosamente, há outros meios para combater a doença.
Relatórios de vários de grupos de pesquisa trabalhando na ataxia de Friedreich mostram que as espécies reativas de oxigênio indubitavelmente desempenham um papel central nesta doença. Quatro anos atrás, sugerimos o uso de um composto - idebenone - que pode contra-atacar o efeito dos radicais de oxigênio. Compostos que neutralizaram espécies reativas de oxigênio são chamados de antioxidantes. Vários antioxidantes têm sido identificados e alguns deles estão disponíveis no mercado como drogas ou até mesmo como vitaminas. Eles têm propriedades ligeiramente diferentes que mudam sua eficiência: neutralizam diferentes espécies de oxigênio; visam órgãos diferentes; penetram em diferentes compartimentos das células. Idebenone foi selecionado com base nas suas propriedades particulares, que parecem ser as melhores no contexto da ataxia de Friedreich. Foram desenvolvidos experimentos diferentes com esta composto e todos menos um (um ensaio muito curto de 6 semanas) concluiu que idebenone (5 mg/kg/dia) tende a reduzir a densidade das paredes do coração e a hipertrofia cardíaca. Isto está resumido na Tabela 1. Em vários pacientes, aumentando a dosagem de 5 para 10 ou até mesmo 15 mg/kg/dia foi considerado benéfico. Infelizmente, idebenone não é uma composto muito estável no organismo e não estamos seguros da quantidade da droga suficiente para obter um efeito máximo. Até onde podemos concluir, a droga não tem um efeito significativo na ataxia. Ainda pode ter algum efeito benéfico na progressão da ataxia, mas como isto é diferente em cada indivíduo afetado, é bastante difícil chegar a uma conclusão firme. A "quantificação" da ataxia (a escala da ataxia) está longe de ser uma tarefa simples, o que aumenta a dificuldade para tirar conclusões. Assim, qualquer efeito da droga no aspecto neurológico não é tão simples de determinar. Porém, o fato de a droga ter alguns efeitos espetaculares na voz e nos movimentos delicados para vários pacientes, indica que ela provavelmente também alcança o sistema nervoso. A ausência de efeitos óbvios de idebenone na ataxia também pode ser resultado do fato de que sua concentração pode não ser suficiente, e que a substituição potencial de células neuronais destruídas é bastante difícil, assim como requer um tempo muito longo. Também, a eficiência de idebenone para contra-atacar espécies reativas de oxigênio em neurônios pode ser modesta.
Conclusão para idebenone (conclusão provisória…): está agora bastante claro que idebenone representa a primeira droga que pode interagir com o curso da doença, especialmente contrariando uma potencial cardiomiopatia de risco. É então altamente recomendável tornar esta droga disponível para todos os pacientes, mesmo que ela não tenha nenhum efeito na ataxia, considerando ainda o fato de que esta droga não tem nenhum efeito colateral significativo em seres humanos.
IV. Novos recursos, novas esperanças
Se quisermos ter uma chance de ganhar a corrida contra a doença, é obrigatório termos um sistema conveniente para identificar drogas e um modelo representativo para testá-las. Durante estes dois últimos anos, ambas as condições tornaram-se disponíveis, embora não estejam absolutamente aperfeiçoadas ainda. Primeiro, foi criado um sistema celular humano que permite a identificação de drogas ativas contra o estresse oxidativo artificialmente induzido. Realmente, foram encontradas condições de cultura com fibroblastos da pele de pacientes que não resistem ao estresse oxidativo, apesar do controle celular. Isto deve permitir a identificação de novos compostos antioxidantes que poderão ser testados em um sistema modelo. Este sistema modelo foi criado utilizando-se ratos nos quais o gene frataxina pode ser inativado após o nascimento, especificamente tanto no coração ou no coração e no sistema nervoso. O resultado desta inativação é a severa redução dos níveis de frataxina nesses tecidos, a perda progressiva de atividade das proteínas de ferro-enxofre, a hipertrofia do coração e a visível deterioração neurológica do rato, sendo a acumulação de ferro observada no estágio final. Assim, este modelo de rato reproduz as características principais da doença e pode ser agora usado para testar drogas in vivo. Com estas ferramentas disponíveis, podemos agora esperar descobrir e testar novas combinações mais ou menos rapidamente.
Para tornar as coisas mais rápidas, poderíamos pensar também (e nós estamos pensando!) em modificar ligeiramente idebenone, tentando aumentar sua estabilidade no organismo humano. Esperamos aumentar sua eficiência em uma dosagem mais baixa. Porém, modificar a molécula (assim como também só mudar sua apresentação e dosagem) requererá estudos tediosos e caros. Somente depois poderemos ter o novo material e torná-lo disponível para pacientes. Mesmo antes de começarmos, temos que extrair da literatura científica todos os dados que descrevam compostos antioxidantes neuroprotetores. Tais compostos existem, e se eles já estiverem disponíveis como drogas, deveriam ser testados urgentemente em pacientes e ser observada sua eficiência e efeitos colaterais em potencial. Se estas substâncias químicas só foram estudadas em modelos de célula, elas deveriam ser testadas agora em ratos modelos de ataxia de Friedreich. É crucial concentrar-se em antioxidantes já identificados e disponíveis se consideramos a demora que pode ocorrer entre a identificação de uma nova molécula em laboratório e sua disponibilidade no mercado.
Conclusão provisória
Espero que este texto tenha sido uma apresentação compreensível do que acreditamos ser o mecanismo de decréscimo do nível de frataxina, causando diminuição da proteína de ferro-enxofre, estresse oxidativo e conseqüente deficiência orgânica da célula, conduzindo à ataxia de Friedreich. Espero ter convencido os leitores que idebenone tem que ser absolutamente utilizado, até mesmo se só proteger o coração. O tratamento não deve ser descontinuado até que uma droga mais eficiente esteja disponível. O tempo não está do nosso lado. Porém, considerando os progressos principais na compreensão desta doença, os novos recursos agora disponíveis para identificar e testar drogas rapidamente e o número de grupos que concentram sua atividade nesta doença e a boa interação entre eles, estou razoavelmente confiante que serão testadas logo novas drogas e tornadas disponíveis para combater a doença.
Tabela 1 - Experimentos de idebenone em FRDA (2002: 6 experimentos, abertos ou placebo controlados) |
1998 3 patients / 6 m treat. / decreased cardiac hypertrophy / no improvement of ataxia |
2001 8 patients / 1 y treat. / scores of ARS scale improved in all patients |
2001 9 patients (5 treated) / 6 weeks treat. / neither improvement of cardiac hypertrophy nor of neurological condition |
2001 11 patients / 1 y treat. / decreased heart hypertrophy in all patients / no improvement of ataxia |
2001 29 patients (15 treated) / 6 m treat. / reduced heart hypertrophy / no improvement of the ARS scale |
2002 38 patients / 6 m treat. / decreased cardiac hypertrophy (50% of the patients) / no improvement of ataxia |
2002 50 patients / 1 y treat. / decreased cardiac hypertrophy / no improvement of ataxia |
2002 122 patients / 0.5 to 3 y treat. / decreased heart hypertrophy / no improvement of ataxia; quite variable improvement of the voice and/or delicate movement |
Estudos recentes sobre ataxia de Friedreich
Adinolfi S, Trifuoggi M, Politou AS, Martin S, Pastore A. (2002) A structural approach to understanding the iron-binding properties of phylogenetically different frataxins. Human Molecular Genetics 11:1865-1877.
Chantrel-Groussard, K., Geromel, V., Puccio, H., Koenig, M., Munnich, A., Rötig, A., Rustin, P. (2001) Disabled early recruitment of antioxidant defenses in Friedreich’s ataxia. Human Molecular Genetics 10: 2061-2067.
Hausse AO, Aggoun Y, Bonnet D, Sidi D, Munnich A, Rötig A, Rustin P. Idebenone reduces cardiac hypertrophy in patients with Friedreich’s ataxia. Heart 87: 346-349.
Huynen MA, Snel B., Bork P., Gibson TJ. (2001) The phylogenetic distribution of frataxin indicates a role in iron-sulfur cluster protein assembly. Human Molecular Genetics 10: 2463-2468.
Piemonte F., Pastore A., Tozzi G., Tagliacozzi D., Santorelli FM, Carozzo R., Casali C., Damiano M., Federici G., Bertini E. (2001) Glutathione in blood of patients with Friedreich’s ataxia. European Journal of Clinical Investigation 31:1007-1011.
Lodi R., Hart PE., Rajagopalan B., Taylor DJ., Crilley JG., Bradley JL, Blamire AM., Manners D., Styles P., Schapira AH. et al. Antioxidant treatment improves in vivo cardiac and skeletal muscle bioenergetics in patients with Friedreich’s ataxia. Annals of Neurology 49:590-596.
Puccio H, Koenig M. (2002) Friedreich ataxia: a paradigm for mitochondrial diseases. Current Opinion in Genetics & Development 12:272-277.
Puccio H, Simon D, Cossée M, Criqui-Filippe P, Tiziano F, Melki J, Kahn R, Hindelang C, Matyas R, Rustin P, Koenig M. (2001) Mouse models for Friedrich ataxia exhibit cardiomyopathy, sensory nerve defect and Fe-S enzyme deficiency followed by intramitochondrial iron deposits. Nature Genetics 27:181-6.
Rustin P, Rötig A, Munnich A, Sidi D. (2001) Heart hypertrophy and function are improved by idebenone in Friedreich’s ataxia. Free Radical Research 36:467-470.