Terapias para Ataxia de Friedreich
Dr Jane L Bradley, Prof Anthony HV Schapira, Dr J Mark Cooper
Royal Free & University College Medical School, London
(publicado em Euro-Ataxia/Newsletter - outubro/2002)
As bases genéticas e os mecanismos da doença inerentes à ataxia de Friedreich (FRDA) foram descritos no artigo do Dr Pierre Rustin e não necessitamos repeti-los aqui. Gostaríamos de esboçar brevemente os objetivos potenciais dos tratamentos em pacientes com FRDA e descrever os atuais resultados dos experimentos terapêuticos da combinação de vitamina E com coenzima Q10.
Possíveis terapias para pacientes com ataxia de Friedreich
A intervenção terapêutica em pacientes com ataxia de Friedreich pode ser usada em diferentes níveis. Em primeiro lugar há as terapias associadas com tratamentos dos sintomas da doença. A FRDA está associada com vários sintomas que envolvem o coração, diabetes, problemas do esqueleto, deglutição, fala, mobilidade e coordenação. É essencial que estes sintomas sejam monitorados e apropriadamente tratados por meio de drogas, cirurgia, fisioterapia, etc. É particularmente importante que os pacientes tenham periodicamente avaliações cardiológicas.
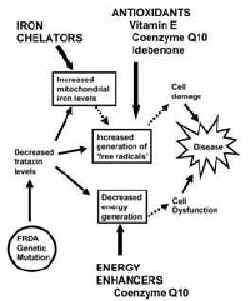
Secundariamente, como começamos a compreender o que funciona mal na FRDA a nível molecular, podemos iniciar o tratamento da doença mais efetivamente. Desde a descoberta da causa genética da FRDA, adentramos um longo caminho na compreensão do efeito desta irregularidade genética. Sabemos que o gene normal da FRDA é responsável pela produção de uma proteína conhecida como "frataxina", encontrada em todas as células do corpo, que com a anomalia genética resulta em níveis diminuídos. Por conseguinte, precisamos entender o que esta proteína normalmente faz (sua função primária) e o que acontece quando esta função é perdida e se isto conduz a problemas adicionais (efeitos secundários). Se for possível substituir a função primária da frataxina então isto atingirá a causa de raiz da doença. Porém, efeitos secundários associados com a perda de frataxina podem também contribuir para a progressão de doença e ser mais receptivos à terapia.
O que atualmente supõe-se que cause a FRDA?
Desde que foi demonstrado que a frataxina está localizada nas mitocôndrias, as chamadas "baterias das células", todo trabalho se concentrou no que ocorre nas mitocôndrias dos pacientes com FRDA. A mitocôndria produz a maioria da energia requerida pela célula para funcionar normalmente e as células que precisam de mais energia - isto é, células dos músculos, do coração e do cérebro - têm muitas mitocôndrias. Nas células dos pacientes de FRDA está claro que há um problema com a produção de energia. Além disso, há evidências de danos por radicais livres e aumento do ferro acumulado nas mitocôndrias. Acredita-se atualmente que todas estas mudanças são efeitos secundários da perda da proteína frataxina, e que esta ou está envolvida em tornar o ferro disponível para reações específicas na mitocôndria, isto é, a produção das proteínas que requerem ferro para sua função normal (as chamadas proteínas de ferro-enxofre), ou como um antioxidante protetor da mitocôndria do dano induzido por "radicais livres" gerados como subprodutos de sua função normal.
Terapias: avaliação de benefícios
A FRDA é uma doença lentamente progressiva que pode afetar várias partes diferentes do corpo, incluindo nervos, espinha dorsal, coração, músculos, olhos e fala. Para entender se uma nova terapia tem alguma influência em quaisquer destes sintomas é importante conhecer como estes sintomas progridem com o passar do tempo, como eles variam entre os pacientes e que fatores pode influenciar esta progressão. Este tipo de informação está começando a ser colecionado e estudado e a nossa compreensão destes processos está agora melhorando.
Além da avaliação dos sintomas clínicos, é possível fazer várias medidas médicas e científicas (biomarcadores) em pacientes para fornecer um melhor entendimento de como as terapias podem evoluir. Atualmente biomarcadores de FRDA têm sido utilizados para avaliar o grau de espessura das paredes do coração (hipertrofia cardíaca - ecocardiografia), a quantidade de energia gerada pelo coração ou músculo esquelético (ressonância magnética espectroscópica 31fosforosa - 31P MRS) e marcadores dos danos devidos a radicais livres.
Além de usar estas medidas, acreditamos também ser importante identificar como a FRDA afeta a vida diária dos pacientes individualmente e obter a própria percepção do paciente em relação à sua inaptidão. Para fazer isto necessitamos um questionário feito sob medida para os pacientes com FRDA e estamos projetando e testando um. Propomos usar o questionário em uma base regular para identificar como a doença progride em uma gama extensiva de pacientes e então usar os resultados para ajudar a determinar como a terapia influencia a progressão da doença.
Terapias: como substituir a função primária da frataxina?
A FRDA é causada por uma diminuição da proteína frataxina. Assim, a terapia ideal envolve o restabelecimento dos níveis de frataxina em todas as células. A mutação genética dos pacientes ocasiona a aderência de moléculas e bloqueio da produção de frataxina. Isto aumenta a possibilidade de encontrar drogas que possam interferir com estas estruturas "aderentes", permitindo a melhoria da produção da proteína frataxina nos pacientes afetados.
Uma estratégia alternativa usa a terapia gênica para acrescentar uma nova cópia funcional do gene frataxina. Como a maioria das células do corpo necessita frataxina, isto exigirá uma nova cópia para alcançar uma gama extensiva de células. Antes disto se tornar uma possibilidade para a FRDA, vários problemas gerais relativos à terapia gênica (também aplicável a outras doenças) precisam ser superados.
Estas estratégias ainda estão longe de se tornar realidade, mas a longo prazo poderão oferecer benefícios significativos.
Terapias: visando efeitos secundários
Quais terapias e por que?
Muitas evidências indicam aumento no dano causado por radicais livres (estresse oxidativo), diminuição na geração de energia e acréscimo na acumulação de ferro mitocondrial em pacientes com FRDA. Embora pareçam ser conseqüências secundárias da perda de frataxina, contribuem indubitavelmente para o dano tecidual e progressão da doença. Pode ser possível combater estes efeitos utilizando-se antioxidantes, aumentos de energia mitocondrial e terapias de quelação de ferro, que podem melhorar a função de muitas células, estabilizando a progressão clínica da doença e resultando possivelmente em melhorias clínicas secundárias (Figura 1).
Terapia antioxidante
Os pacientes de FRDA foram tratados com uma variedade de antioxidantes, inclusive idebenone, coenzima Q10 e vitamina E. Relatórios sucintos do uso de N-acetilcisteína também sugerem benefícios [http://internaf.org/ataxia/nacupd.html].
Idebenone é uma versão modificada de coenzima Q10, sendo bem tolerada pelas pessoas, atravessa a barreira hematoencefálica, tem sido relatado como um antioxidante relativamente bom e é usado em várias doenças com alguns benefícios. O efeito de idebenone em hipertrofia cardíaca em pacientes de FRDA foi avaliado por ecocardiografia e está descrito no artigo do Dr Pierre Rustin.
Terapia combinada de vitamina E com coenzima Q10
A vitamina E é um antioxidante de ocorrência natural encontrado em todas as membranas celulares do corpo, mas predominantemente em membranas mitocondriais, protegendo-as de danos por radicais livres. É obtida na dieta, e óleos vegetais e nozes provêem uma fonte particularmente rica. Os benefícios potenciais da vitamina E para pacientes com FRDA são fortalecidos pela observação de que uma doença com sintomas clínicos muito similares à FRDA é causada por uma deficiência de vitamina E e responde à terapia com vitamina E. A vitamina E tem sido ingerida em doses elevadas por adultos (acima de 1500-2100 UI por dia) com poucos efeitos colaterais [Referência 1] e aumenta o nível de vitamina E em uma variedade de tecidos, inclusive do cérebro, dos músculos e do coração. Tem sido usada para tratar doença cardiovascular, doença de Parkinson e cânceres com variados graus de sucesso.
A coenzima Q10 (CoQ10) é encontrada naturalmente nas células, atuando como antioxidante e desempenhando função no sistema de geração de energia nas mitocôndrias. Em conseqüência, pode agir não só protegendo a célula contra os danos por radicais livres, mas também aumentando a habilidade das mitocôndrias em sintetizar energia para a célula. Até 5 mg/dia podem ser consumidos em uma dieta comum (rica em óleo de soja, carne e peixe), mas doses maiores por períodos prolongados não dão origem a efeitos colaterais significativos [Referência 2]. A CoQ10 é levada prontamente para o sangue, cérebro e fígado e pode interagir com a vitamina E de um modo positivo, o que sugere que pode ser mais benéfico quando os dois são combinados em uma terapia. Conseqüentemente, a CoQ10 não só pode proteger as células dos danos causados por radicais livres, mas também pode melhorar a provisão de energia em pacientes de FRDA.
Usando uma técnica conhecida como ressonância magnética espectroscópica 31fosforosa (31P MRS), em colaboração com a Unidade MRS do John Radcliffe Hospital, em Oxford, demonstramos claramente que a energia produzida pelo coração e pelo músculo esquelético diminui em pacientes com FRDA. Isto está de acordo com a hipótese de que a falta da proteína frataxina no componente produtor de energia da célula (mitocôndria) afeta a habilidade da célula produzir energia e compromete a função normal destes órgãos, contribuindo assim para os sintomas clínicos.
Nós vimos utilizando uma terapia combinada de antioxidante e incremento de energia em 10 pacientes de FRDA, com uma alta dose de vitamina E (adulto 2100 UI/dia) combinada com uma dose de CoQ10 (adulto 400 mg/dia), durante mais de três anos, para determinar a produção de algum impacto nos sintomas clínicos, problemas de coração e energia produzida pelo coração e músculo esquelético.
Após seis meses de terapia a energia produzida pelo coração e músculo esquelético melhorou significativamente [Referência 3] e estas melhoras foram mantidas ao longo dos três anos de terapia. Após três anos de acompanhamento os dados deste estudo mostram que os parâmetros clínicos foram estabilizados ou melhoraram em 8 entre 10 pacientes e a função do coração melhorou. Estes dados são extremamente encorajadores, mas a ausência de um grupo placebo tornou difícil a interpretação dos dados clínicos, pois não se sabe como os pacientes teriam progredido na ausência da terapia. Assim, iniciamos um experimento de dois anos com um grupo de controle placebo duplo-cego para avaliar esta terapia sob critérios científicos mais estritos.
Terapia de quelação de ferro
A acumulação de ferro nas mitocôndrias de pacientes de FRDA pode potencialmente gerar prejudiciais moléculas de radicais livres. Por conseguinte, remover ou isolar este ferro através da terapia de quelação pode trazer benefícios clínicos. Esta abordagem foi bem sucedida em um modelo de fermento da doença. Porém, terapias padrão de quelação de ferro não foram capazes de diminuir os níveis de ferro nas mitocôndrias. Um problema adicional relaciona-se ao fato de que os pacientes de FRDA têm níveis normais de ferro no sangue e o ferro é necessário em muitas funções importantes do corpo. Se a quelação de ferro diminui o nível geral de ferro, então isto aumentará os problemas clínicos. Até hoje não houve nenhuma avaliação publicada de terapia de quelação de ferro em FRDA. O desenvolvimento de novos queladores de ferro que possam especificamente atingir o ferro mitocondrial poderá vir a ser uma abordagem eficaz.
Terapia mitocondrial
O problema primário em FRDA está localizado na mitocôndria e assim seria de se esperar que uma terapia que visasse especificamente a mitocôndria poderia ser mais eficiente. A modificação química de agentes terapêuticos objetivando atingir especificamente as mitocôndrias pode melhorar sua eficácia. Esta abordagem foi desenvolvida em laboratório para vitamina E e resultou em um aumento da vitamina E mitocondrial. Tais combinações não foram ainda usadas em pacientes, mas podem vir a ser de particular benefício em FRDA.
Conclusão
Muitos dos sintomas associados com FRDA podem ser administrados com tratamentos convencionais e é imperativo que os pacientes sejam acompanhados regularmente por médicos especialistas. Avanços em nossa compreensão dos mecanismos subjacentes da doença FRDA estão habilitando o estabelecimento do uso de drogas como potenciais terapias, em particular tratamentos antioxidantes. Melhorias em nossa compreensão de como a doença progride em diferentes indivíduos e de quais fatores influenciam a progressão em conjunção com melhores métodos para avaliar as várias inaptidões associadas com FRDA também permitem uma melhor avaliação de terapias experimentais. Quando se avaliam as alterações de terapias, a natureza relativamente lenta da progressão da doença requer períodos relativamente longos de tratamentos (mais de dois anos) para que alguma modificação possa ser observada e demonstrada consistente.
Os resultados do nosso experimento combinado de vitamina E com CoQ10 são muito encorajadores. Eles mostram claramente que há um rápido e contínuo aumento na energia gerada no coração, atingindo quase níveis normais. As melhorias na geração de energia do músculo esquelético comparam-se as do coração, embora menos dramáticas. Clinicamente pudemos demonstrar um aumento nas funções do coração depois de três anos de terapia, conquanto não tenha havido nenhuma melhora consistente na densidade das paredes do coração. Os sintomas clínicos globais foram avaliados depois dos três anos do experimento e os escores clínicos foram melhores do que os previstos em 8 entre 10 pacientes, sugerindo que a terapia modificou o curso clínico da doença. Uma avaliação mais detalhada da influência da terapia na progressão clínica aguarda os resultados de um experimento controlado com placebo duplo-cego com 50 pacientes durante dois anos.