Função
Química
É o conjunto de compostos
que têm um comportamento químico
semelhante.

Função
Química: Hidrocarbonetos
Hidrocarbonetos
são compostos que apresentam exclusivamente
carbono e hidrogênio em suas moléculas.
Características:
São apolares;
Moléculas unidas por força de
Van der Waals;
Baixo PF e PE em comparação a
compostos polares;
Quanto à fase de
agregação, podemos fazer a seguinte
generalização, à temperatura
e pressão ambientes: os hidrocarbonetos
que possuem de 1 a 4 carbonos são gasosos,
de 5 a 17 carbonos são líquidos
e acima de 17 carbonos são sólidos.
Dissolvem-se apenas
em substâncias apolares (semelhante dissolve
semelhante), sendo insolúveis em água.
São menos densos que a água, por
dois motivos principais:
1) os átomos que os
formam possuem massas atômicas baixas
(C = 12) (H = 1);
2) suas moléculas, sendo apolares, tendem
a ficar mais distantes entre si, o que implica
menos moléculas por unidade de volume.
Os hidrocarbonetos são
encontrados no petróleo, no gás
natural, em resinas vegetais etc.; eles servem
também como produtos intermediários
em indústrias importantes, como as de
plásticos, fibras têxteis, borrachas
sintéticas, corantes, explosivos, etc.
Os hidrocarbonetos constituem
uma classe muito numerosa e muito importante,
pois formam o “esqueleto” de todos
os demais compostos orgânicos. Assim essa
função é considerada fundamental
na Química Orgânica, pois a partir
dela teoricamente derivam todas as outras funções.
Grupo Funcional:
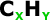
Eles se subdividem
em várias subclasses, das quais as mais
importantes são: alcanos, alcenos, alcinos,
alcadienos, cicloalcanos, cicloalcenos, hidrocarbonetos
aromáticos.
Dois critérios interferem
na classificação dos hidrocarbonetos:
Se a cadeia e fechada ou aberta
e se é insaturada ou saturada.
Alcanos ou Parafinas
(Hidrocarbonetos Parafínicos)
São hidrocarbonetos
de cadeia aberta e saturada.
A importância dos alcanos
é enorme, pois são os principais
formadores do petróleo.
A proporção
fixa entre o número de átomos
de carbono e hidrogênio é denominada
fórmula geral. Com base em um composto
da classe, pode-se saber a fórmula geral.
Para os alcanos, temos:
Fórmula Geral:
Em que “n” é um número
inteiro.
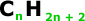
Exemplo:
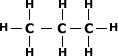
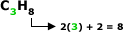 Note que a quantidade de H é sempre o
dobro da quantidade de carbono mais 2.
Note que a quantidade de H é sempre o
dobro da quantidade de carbono mais 2.

Alcenos, Alquenos –
Olefinas, Hidrocarbonetos Etilênicos (ou
hidrocarbonetos Acetilênicos).
Os alcenos têm muita
importância na indústria petroquímica,
pois constituem as matérias-primas para
a fabricação dos mais importantes
plásticos, fibras têxteis e borrachas
sintéticas da atualidade.
São hidrocarbonetos
acíclicos, contendo
uma dupla ligação.
Fórmula Geral:
Em que “n” é = 2.

Exemplo:
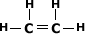 Note que a quantidade de hidrogênio e
sempre o dobro da quantidade de carbono.
Note que a quantidade de hidrogênio e
sempre o dobro da quantidade de carbono.
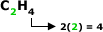

Alcinos, Alquinos ou
Hidrocarbonetos Acetilênicos (Hidrocarbonetos
Etínicos)
Os alcinos são matérias-primas
para a fabricação de muitos produtos
de grande importância industrial, como,
por exemplo, plásticos, solventes, etc.
São hidrocarbonetos
acíclicos, contendo
uma tripla ligação.
Fórmula Geral: Em que
“n” é = 2.

Exemplo:
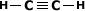 Note que a quantidade de hidrogênio e
sempre o dobro da quantidade de carbono, menos
2.
Note que a quantidade de hidrogênio e
sempre o dobro da quantidade de carbono, menos
2.
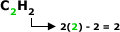

Alcadienos, Dienos
ou Dioleofinas
São hidrocarbonetos
que apresentam cadeia cíclica
e insaturada, com duas
duplas ligações entre
os carbonos.
Fórmula Geral:

Exemplo:
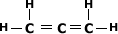 Alcadieno Acumulado
Alcadieno Acumulado 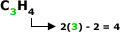
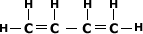 Alcadieno Conjugado
Alcadieno Conjugado 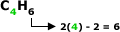
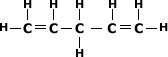 Alcadieno Isolado
Alcadieno Isolado 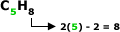

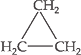
Cicloalcanos, Ciclano
ou Cicloparafina
São hidrocarbonetos
que apresentam cadeia cíclica
e saturada.
Fórmula Geral:
Com “n” = 3.

Exemplo:
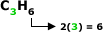

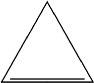
Cicloalcenos, Cicloalquenos,
Ciclenos ou Ciclolefinas
São hidrocarbonetos
de cadeia cíclica que apresentam uma
ligação dupla.
Fórmula Geral:
Com “n” =3.

Exemplo:
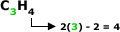
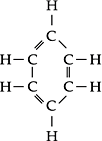
Hidrocarbonetos Aromáticos
São hidrocarbonetos
cíclicos, insaturados
e que possuem possuem 4n + 2 = elétrons
pi em que “n” é
um número inteiro. (Regra de Hückel).
Formula Geral: Não é possível
estabelecer uma fórmula geral que englobe
todos os hidrocarbonetos aromáticos.
Mas quando for um hidrocarboneto aromático
mononuclear, apresenta.
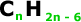
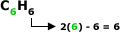 A quantidade de H é igual ao dobro
da quantidade de C, menos 6.
A quantidade de H é igual ao dobro
da quantidade de C, menos 6.
Exemplo: