O elemento Químico
Carbono - C
Como
o carbono é a unidade fundamental dos
compostos orgânicos, torna-se necessário
um conhecimento mais profundo sobre esse elemento.
A estrutura dos compostos orgânicos começou
a ser desenvolvidas a partir do segunda metade
do século XIX, com as idéias de
Couper (1831 – 1892) e Kekulé sobre
o comportamento do carbono. Dentre essas idéias,
hoje conhecidas por Postulados de Couper-Kekulé,
três são fundamentais.
Postulados de Couper-Kekulé
1° Postulado:
O átomo de carbono é tetravalente.
Este postulado
nos mostra que o átomo de carbono pode
estabelecer quatro pares eletrônicos,
ou seja, quatro ligações.
O átomo de carbono
tem número atômico 6, o que significa
que ele apresenta seis elétrons distribuídos
nas camadas K e L.
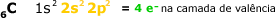
Por apresentar
4 elétrons na camada de valência
o C, pode compartilhar 4 pares eletrônicos
com outros átomos, de modo a completar
o octeto e, assim se estabilizar.

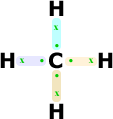 Observe
a estabilização de um átomo
de carbono com átomos de hidrogênio.
Observe
a estabilização de um átomo
de carbono com átomos de hidrogênio.
2° Postulado:
As quatro unidades de valência do carbono
são iguais entre si.
Um composto
de Fórmula molecular 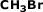 apresenta as seguintes conformações.
Mudando a posição do átomo
de boro, podemos escrever:
apresenta as seguintes conformações.
Mudando a posição do átomo
de boro, podemos escrever:
Está provado
que só existe um composto de fórmula
, o que nos permite dizer que as 4 fórmulas
acima representam um único composto.
Esse fato nos leva, então à conclusão
de as 4 valências do carbono são
exatamente iguais entre si.

3º Postulado:
Átomos de carbono ligam-se entre si,
formando estruturas denominadas cadeias carbônicas.
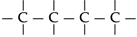
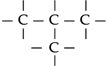
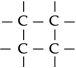
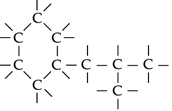
Os átomos
de carbono podem ligar-se entre si formando
cadeias. Isso explica o fato de existirem mais
de quatro milhões de compostos orgânicos.
Os átomos de carbono podem formar cadeias
abertas ou fechadas (anéis); tanto as
cadeias abertas como as fechadas podem se ramificar
e ligar-se umas às outras:
A capacidade que alguns
elementos têm de se ligarem entre si e
característica de alguns elementos tais
como: enxofre, nitrogênio, oxigênio
e fósforo.
No entanto, essa capacidade,
para o carbono é tão pronunciada
que já se conhecem cadeias carbônicas
com milhares de átomos de carbono ligados
entre si. Devido a essa acentuada capacidade
do carbono de formar cadeias e que se conhece
um número extremamente grande de compostos
orgânicos.
Fórmulas
Químicas
A representação
do numero e dos tipos de átomos que formam
uma molécula é feita por uma fórmula
química, existindo diferentes
tipos de fórmulas.
Fórmula molecular:
Fornece o número de átomos de
cada elemento químico que se combinam
para formar moléculas.
Exemplo: 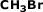
Veja que a fórmula nos
mostra que existem 3 átomos de
H, 1 átomo de Br
e outro de C.

Fórmula Eletrônica
ou de Lewis: Mostra, além dos
elementos e do número de átomos
envolvidos, os elétrons da camada de
valência de cada átomo e a formação
dos pares eletrônicos.
Exemplo:
 Veja
que a fórmula nos mostra o compartilhamento
dos pares eletrônicos.
Veja
que a fórmula nos mostra o compartilhamento
dos pares eletrônicos.

Fórmula Estrutural
Plana: Evidencia a estrutura da ligação,
ou seja, cada ar de elétrons compartilhados
entre dois ou mais átomos (sendo 1 elétron
de cada átomo) é representado
por um traço.
Exemplo:
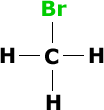
Fórmula Estrutural
Plana Condensada: 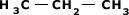
Fórmula Estrutural Plana Condensada mais
ainda: 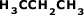

Fórmula (bond Line formula)
não possui nome oficial em português,
mas, em inglês.
Representa cadeias carbônicas em ziguezague
formando vértices. Cada vértice
indica um átomo de carbono.
Os átomos de H que
se encontram ligados aos átomos de carbono
não são representados. Pois e
preestabelecido que as ligações
do carbono que estão faltando estão
sendo feitas com hidrogênio.
Apenas os átomos
diferentes de carbono e hidrogênio são
representados por seus símbolos e são
ligados à cadeia carbônica por
uma linha menor do que a que forma o ziguezague.
As ligações
duplas e triplas são representadas normalmente.
Exemplo:

Classificação
dos Átomos de Carbono Numa Cadeia Carbônica
Numa cadeia, cada carbono é
classificado de acordo com o número de
outros átomos a ele ligados. Assim temos:
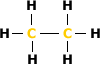
Carbono Primário: É
aquele ligado diretamente a apenas um outro
átomo de carbono.
Exemplo:
 Veja
que os átomos de carbono só se
ligam a apenas um outro carbono.
Veja
que os átomos de carbono só se
ligam a apenas um outro carbono.
Carbono Secundário:
É aquele ligado diretamente a dois átomos
de carbono.
Exemplo:
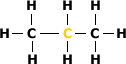 Veja que o átomo de carbono central está
ligado a outros dois átomos de carbono.
Veja que o átomo de carbono central está
ligado a outros dois átomos de carbono.
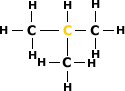
Carbono Terciário:
É aquele ligado diretamente a três
átomos de carbono.
Exemplo:
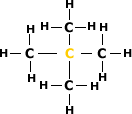
Carbono Quaternário:
É aquele ligado diretamente a quatro
átomos de carbono.
Exemplo:
Classificação
dos Átomos de Hidrogênio
A classificação
do hidrogênio na cadeia carbônica
baseia-se na classificação do
átomo de carbono. Assim temos:
Hidrogênio Primário:
É aquele ligado a um carbono primário.
Exemplo:
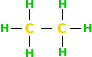 6 hidrogênios primários
6 hidrogênios primários
Hidrogênio Secundário:
É aquele ligado a um carbono secundário.
Exemplo:
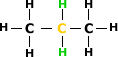 2 hidrogênios secundários
2 hidrogênios secundários
Hidrogênio Terciário:
É aquele ligado a um carbono terciário.
Exemplo:
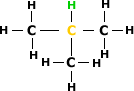 1 hidrogênio
primário
1 hidrogênio
primário



