Compuesta por 3 átomos, dos de Oxigeno y uno de carbono, con lo que vamos a tener un total de 16 e- que distruir, solo tenemos en cuenta los electrones de valencia de los átomos.
Oxigeno: 1s(2), 2s(2), 2p(4)
Carbono: 1s(2),2s(2)2p(2)
Los cuatro enlaces del carbono se explican con orbitales atómicos híbridos, pese tener cuatro enlaces su número de coordinación es dos, ya que los enlaces dobles contribuyen como uno al número de coordinación, con lo que el número de orbitales híbridos que necesitamos es dos. Siendo el resultado de la combinación de los orbitales 2s y 2px del carbono, dan lugar a orbitales sp. El haber cogido el orbital 2px en vez de los 2pyo 2pz es algo arbitrario, depende de la dirección en que consideremos que se forma el enlace.
Las funciones de onda asociadas a estos orbitales son:
Ysp(1) = C (2s + 2px)
Ysp(2) = C (2s- 2px )
C es una cte de normalización y toma el valor de raíz de un medio.

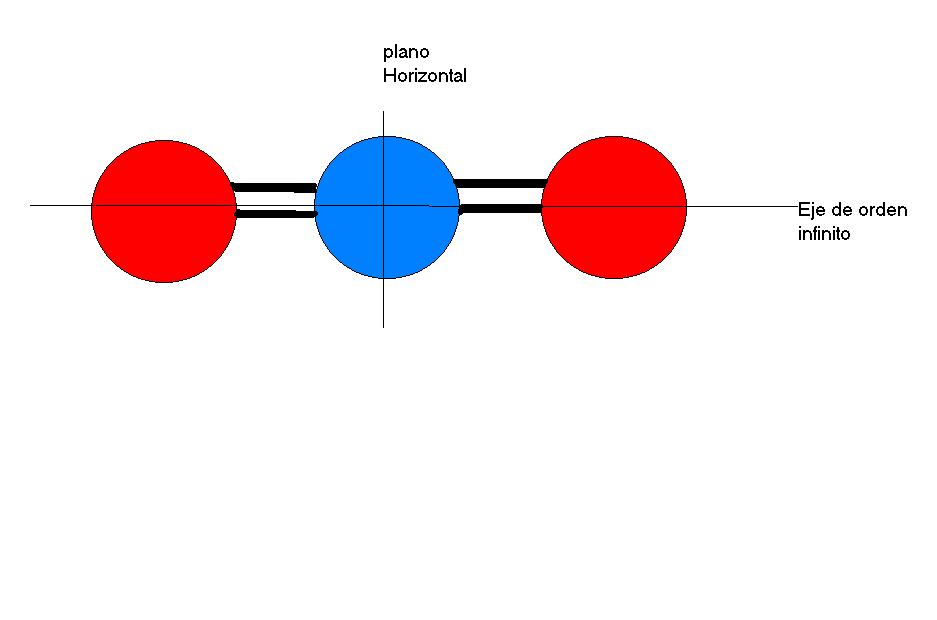
Desde el punto de vista de la simetría es una molécula interesante,es una molécula lineal que presenta un eje de rotación de orden infinito, es decir, entorno a él, la molécula puede girar cualquier ángulo dejándola invariante, conteniendo a este eje tenemos infinitos planos de simetría de tipo v (por contener al eje de mayor orden).También, posee centro de inversión, situado en el átomo central y un plano de simetría que por ser perpenticular al eje de mayor orden se denomina Plano horizontal.
Es un gas incoloro e inodoro mas denso que el aire que se eleva debido al viento, es fundamental en muchos procesos de la vida como la fotosíntesis. Por el contrario el Monóxido de carbono es bastante tóxico.
Se produce en combustiones de todo tipo de compuestos carbónicos, es muy abundante ya que se desprende por las chimeneas de las fábricas, por los tubos de escape de los automóviles ( emiten 283 gr al Km) y en muchos procesos naturales como la respiración: en la que se consume oxígeno y se desprende CO2; el proceso inverso es la fotosíntesis: consumo de CO2 y desprendimiento de O2, este proceso lo relizan las plantas y árboles, y como consecuencia de la deforestación, el consumo de CO2 por fotosíntesis disminuye, con lo que cada vez hay mas CO2 en la atmósfera y el recalentamiento del planeta es mayor.
La fotosíntesis viene a ser:
6CO2 + 6H2O dan lugar a C6H12O6 (glucosa) + 6O2
Una importantisima reacción en la que se produce el CO2 es la combustión de Metano, que es el principal constituyente del gas Natural que se consume todos los dias en grandes cantidades:
CH4 + 2O2 dan lugar a CO2 + 2H2O
Una reaccion representativa de la combustion de combustibles fósiles como el petróleo es la siguiente:
2 C8H18 +25 O2 dan lugar a 16 CO2 + 18 H2O
Es una molécula apolar, es decir presenta un momento dipolar nulo, esto es debido a entorno a el carbono tenemos dos átomos idénticos. En cambio, el monóxido carbónico es una molécula polar, esto es debido a que es una molécula diatómica heteronuclear, y no tiene la simetría que presenta el dióxido de carbono.
Tiene
su punto triple (coexistencia de fase liquida, gaseosa y solida) a 5,1
atm y -56 grados celsius, su temperatura crítica es de 31 grados
celsius, a partir de la cual no se distingue fase líquida de fase
gaseosa.