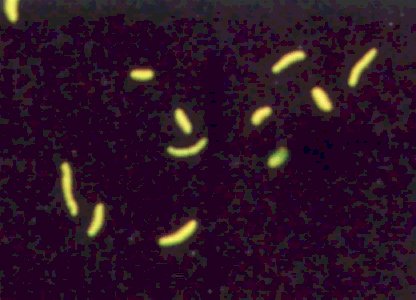
TUBERCULOSIS PULMONAR
DIAGNOSTICO
El diagnóstico definitivo de tuberculosis sólo puede establecerse cuando se cultiva M. tuberculosis. Sin embargo, existen otras pruebas diagnósticas, que se expondrán a continuación, que ayudan a plantear el diagnóstico de esta enfermedad. Pruebas microbiológicas. Las características tintoriales de M. tuberculosis permiten su rápida visualización (baciloscopia) en muestras clínicas mediante el uso de diferentes técnicas de tinción. El escaso número de bacilos presente en la mayoría de estas muestras hace generalmente necesario el estudio de más de una antes de que pueda alcanzarse un diagnóstico definitivo. La presencia de abundantes ácidos grasos en la pared de M. tuberculosis la hace ser ácido-alcohol-resistente. Es decir, que tiene la propiedad de retener ciertos colorantes de anilina a pesar de ser tratados con un ácido y alcohol.

En este hecho se basa la técnica de Ziehl-Neelsen, en la que se emplea como colorante fucsina fenicada calentada, decolorada con ácido-alcohol y contrateñida con azul de metileno. La tinción de Kinyoun es similar a la de Ziehl-Neelsen, pero no utiliza el calor para favorecer la captación de la tinción. Las técnicas flurocrómicas con auramina-rodamina se basan en el mismo principio básico, pero permiten una más rápida y más cómoda visualización de las micobacterias que muestran una llamativa fluorescencia amarilla anaranjada cuando se observan con microscopio de campo oscuro. Con cualquiera de estas técnicas, M. tuberculosis se observa como un bacilo de menos de 0,5 mm de diámetro que puede formar parejas o grupos característicos de unos pocos microorganismos en forma de cuerdas. El hecho de que M. tuberculosis necesite 5-20 horas para duplicarse explica que el cultivo de esta micobacteria exija un tiempo muy prolongado, entre 4 y 8 semanas, en los medios de cultivo convencionales de Löwenstein-Jensen o de Middelbrook. Los modernos métodos radiométricos (sistema Bactec (r) ) permiten acortar sustancialmente el tiempo necesario para el crecimiento de M. tuberculosis, aunque la identificación definitiva puede requerir más tiempo. La hibridación con sondas de DNA permite la rápida identificación de la especie de micobacteria aislada en cultivo. La rentabilidad diagnóstica de la baciloscopia y del cultivo está directamente relacionada con la extensión de la enfermedad. La baciloscopia será positiva en una tercera parte, aproximadamente, de los pacientes en los que el cultivo de esputo es positivo, pero este porcentaje puede aumentar hasta el 69 o 70 % si se hace un mayor número de baciloscopias, aunque raras veces es necesario recoger más de 3 esputos para conseguir una baciloscopia positiva. En general, la rentabilidad de la baciloscopia del esputo dependerá del tipo de lesión pulmonar. Son necesarios 10.000 bacilos/ml de esputo para que la baciloscopia sea positiva. Por lo tanto, en las lesiones pulmonares pequeñas, poco bacilíferas, pueden necesitarse más número de esputos; por el contrario, si un paciente tiene una gran caverna y la baciloscopia es negativa, se debería ir pensando en un diagnostico alternativo. Si el paciente no expectora, puede inducirse el esputo o realizar una broncoscopia o un aspirado traqueal. El jugo gástrico es una buena muestra para investigar la presencia de micobacterias digeridas desde las vías respiratorias, ya que aunque teóricamente es posible confundirse con otras micobacterias saprófitas, el número de éstas en el estómago es tan escaso que la baciloscopia no podría ser positiva.
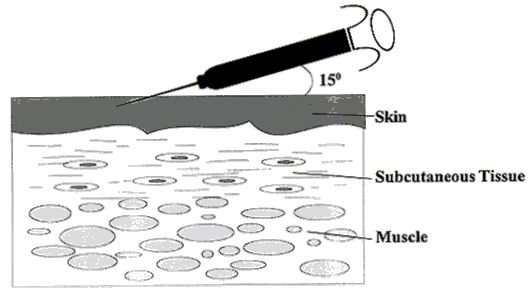
Prueba tuberculínica. La prueba tuberculínica es una reacción cutánea de hipersensibilidad que indica la existencia de infección tuberculosa previa. La prueba se lleva a cabo con un extracto proteico purificado (PPD) de M. tuberculosis. En España se usa el lote RT-23 del PPD, que debe administrarse por vía intradérmica (intradermorreacción de Mantoux) aplicando en la cara anterior del brazo 0,1 ml que contienen 2 unidades de PPD RT-23, que son equivalentes a 5 unidades del antígeno de referencia (denominado PPD-S).
Las reacciones deben leerse midiendo el diámetro transverso de la zona de induración a las 48-72 horas. En España, un Comité Nacional de Expertos ha recomendado que la prueba se considere positiva a partir de 5 mm. Conviene recordar que la prueba tuberculínica puede ser positiva si el paciente ha tenido contacto con otras micobacterias no tuberculosas. Por ello, en los países con una alta incidencia de otras micobacteriosis, para considerar que un paciente ha tenido contacto con M. Tuberculosis se exigirá un mayor tamaño de la prueba tuberculínica.
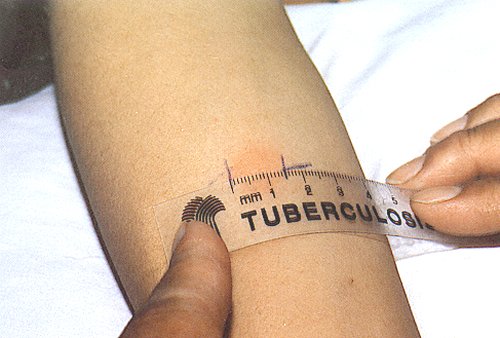
En los pacientes que han sido vacunados contra la tuberculosis con BCG, la prueba tuberculínica puede ser positiva durante un período aproximado de 10 años. En los vacunados, la reacción se considerará positiva cuando sea mayor de 14 mm. La repetición de la prueba tuberculínica en un determinado individuo infectado no lo sensibiliza frente a pruebas posteriores. Sin embargo, sí puede reactivar la hipersensibilidad (efecto booster o rebrote) de algunos sujetos con prueba tuberculínica negativa que tuvieron en los años previos algún contacto con una especie de micobacteria o que fueron vacunados. Por ese motivo, debe considerarse con precaución el aumento de pequeño tamaño en la prueba tuberculínica cuando ésta se repite anualmente (p. ej., en las revisiones de empresas).
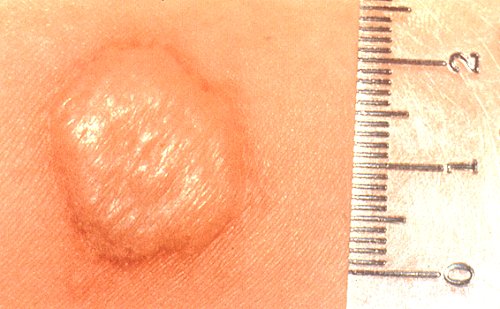
Para diferenciar el denominado efecto rebrote o efecto booster de una verdadera primoinfección debería repetirse la prueba tuberculínica a los 10-20 días a los que la tuvieron inicialmente positiva. Si entonces resulta positiva, se estaría en presencia de este efecto y no de una verdadera primoinfección. La prueba tuberculínica puede ser falsamente negativa en casos de anergia cutánea, que está presente hasta en un 15 % de los pacientes con primoinfección tuberculosa y en aproximadamente la mitad de los que desarrollan tuberculosis miliar. Para descartar la existencia de anergia, deben realizarse otras pruebas cutáneas con otros antígenos. Otras pruebas diagnósticas. Existen diferentes técnicas serológicas que pueden contribuir al diagnóstico de tuberculosis, si bien hasta ahora no se ha generalizado el uso de ninguna de ellas. Para que estas pruebas puedan ser más específicas se necesitan antígenos altamente purificados, como el MTP 40, un antígeno específico de M. Tuberculosis recientemente identificado. La técnica de ELISA ofrecería el mayor potencial para la realización de pruebas serológicas rápidas y podría ser de gran valor cuando sea difícil obtener muestras de esputo, como sucede en niños y en pacientes con tuberculosis extrapulmonar. La sensibilidad de estas pruebas parece ser similar a la de la baciloscopia de esputo. La cuantificación de la enzima adenosindesaminasa (ADA) en ciertos líquidos corporales puede tener cierta utilidad para diagnosticar la tuberculosis, aunque la prueba carece de suficiente especificidad. Mediante cromatografía pueden identificarse los componentes lipídicos de la pared celular característicos de cada micobacteria. Este método parece ser muy específico y bastante sensible, pero hasta el momento es poco práctico, ya que sólo esta disponible en laboratorios de referencia. Recientemente se ha destacado la alta sensibilidad y especificidad diagnóstica de las técnicas de amplificación de DNA de micobacterias mediante la técnica de PCR. Aunque los primeros datos son ciertamente prometedores, la aplicabilidad real de esta técnica en el diagnóstico convencional de la tuberculosis está todavía por definir. Otras técnicas que se sirven también de la PCR pueden ser útiles en el futuro para la detección precoz de cepas resistentes de M. tuberculosis y para el seguimiento epidemiológico de ciertos brotes de la enfermedad.
VOLVER
AL INDICE DE TUBERCULOSIS PULMONAR ![]()
CONTINUAR
CON EL SIGUIENTE DOCUMENTO: TRATAMIENTO ![]()
VOLVER
AL DOCUMENTO ANTERIOR: TB. PULMONAR ![]()
