En Argentina está prohibida la comercialización o entrega gratuita de especialidades medicinales o farmacéuticas no registradas ante la autoridad sanitaria nacional. Cada vez que se quiere producir o importar una nueva especialidad medicinal, exista o no una similar en el mercado, se debe cumplir con una serie de requisitos.
Para obtener el certificado que habilita a un medicamento para la comercialización debe solicitarse la inscripción al Registro de Especialidades Medicinales o farmacéuticas. El trámite se realiza en la ANMAT (ver recuadro).
Medicinas de producción nacional
Para tramitar el registro de un medicamento elaborado en el país se requiere contar con la siguiente información:
a) Del producto: El nombre propuesto y la fórmula (definida y verificable); la forma o formas farmacéuticas en que se presentará; la clasificación farmacológica, haciendo referencia al número de código -si existiere- de la clasificación internacional de medicamentos de la Organización Mundial de la Salud (OMS); la condición de expendio;
b) Información técnica: El método de control; el período de vida útil; el método de elaboración en conformidad con las prácticas adecuadas de fabricación vigentes; los datos sobre la biodisponibilidad del producto;
c) Proyectos de rótulos y etiquetas que deberán contener: Nombre y dirección del laboratorio, nombre del director técnico, nombre del producto y nombre genérico en igual tamaño y realce, fórmula por unidad de forma farmacéutica o porcentual, contenido por unidad de venta; la fecha de vencimiento; la forma de conservación y la condición de venta, número de partida y serie de fabricación; y la leyenda "Medicamento autorizado por el Ministerio de Salud y Acción Social, certificado Nº:";
d) Proyectos de prospectos que reproducirán: Las inscripciones no variables de los rótulos y etiquetas; la acción o acciones farmacológicas y terapéuticas que se atribuyen al producto con indicaciones clínicas precisas y con advertencias, precauciones y, cuando corresponda, de antagonismos, antidotismos e interacciones medicamentosas y de los efectos adversos que puedan llegar a desencadenar, posología habitual y dosis máximas y mínimas, forma de administración, presentaciones.
A partir de la solicitud de inscripción el Ministerio de Salud y Acción Social tendrá un plazo de 120 días para expedirse, según lo establece el decreto 150/92.
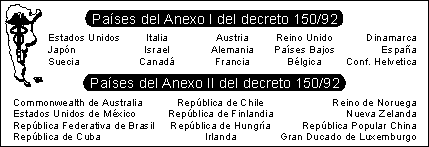
Si la medicina es una novedad sin otra similar ya registrada -un producto nuevo- se debe acompañar la solicitud de registro con la documentación que acredite la eficacia e inocuidad del producto para el uso presupuesto. Quedan exceptuadas las especialidades medicinales que, aunque sean novedad en el país, estén autorizadas para el consumo público en alguno de los países del anexo I del decreto 150/92 (cuadro I).
Inscripción de medicinas para importación
Las especialidades medicinales o farmacéuticas a importarse se dividen para su tramitación en tres grupos que dependen del país de origen.

Originarias de los países del anexo II del decreto 150/92: además de la información requerida para la autorización de productos nacionales deberá agregarse un certificado de la autoridad sanitaria del país de origen, emitido de conformidad a la resolución W.H.A. 41.18.1988 de la Asamblea Mundial de la Salud, o la que la sustituya.
Estas especialidades medicinales deben ser elaboradas en laboratorios farmacéuticos con plantas aprobadas por entidades gubernamentales de países que figuran en el anexo I del decreto 150/92 (cuadro I) o por la Secretaría de Salud del Ministerio de Salud y Acción Social, y que cumplan los requisitos de normas de elaboración y control de calidad exigidos por la autoridad sanitaria nacional. La verificación de las plantas elaboradoras será efectuada por la Secretaría de Salud del Ministerio de Salud y Acción Social dentro de los sesenta días de presentada la solicitud de inscripción.
Los medicamentos de este grupo deberán estar autorizados y comercializándose en los países de origen antes de solicitar el registro o importación ante la autoridad sanitaria nacional. Si la especialidad medicinal no fuera similar a otra ya inscripta en el registro de la autoridad sanitaria nacional, deberá acreditarse la eficacia e inocuidad del producto.
El plazo del trámite también será de 120 días pero comenzarán a contarse a partir de la verificación de la planta elaboradora.
Originarias de los países del anexo I del decreto 150/92: en el caso de que estén autorizadas para su consumo público en el mercado interno en al menos uno de los países de este grupo, pueden inscribirse para su autorización en el Registro de la Autoridad Sanitaria Nacional. El interesado debe presentar la certificación oficial vigente de la autorización, la información solicitada en los puntos c y d para productos de industria nacional y los datos referidos a la biodisponibilidad.
Esta inscripción tiene carácter automático y se otorga sólo para la importación y comercialización. Para la elaboración local y seguida comercialización de especialidades medicinales similares o equivalentes, se deben seguir los pasos indicados para medicinas de producción nacional.
Originarias de países que no figuran en ninguno de los anexos del decreto 150/92: si no estuviese autorizada la especialidad en ninguno de los países del anexo I, se debe realizar el mismo trámite que requieren las medicinas a importarse de países del anexo II del decreto 150/92 y además presentarse la documentación que acredite la eficacia e inocuidad del producto para el uso presupuesto.
Producción y fraccionamiento
Los establecimientos instalados en territorio argentino dedicados a la producción o fraccionamiento de medicamentos y de drogas destinadas a ser utilizadas en la preparación de medicamentos, deben funcionar bajo la dirección técnica de farmacéuticos o químicos u otros profesionales con títulos habilitantes, según la naturaleza de los productos.
El o los titulares de los establecimientos y el director técnico serán igual y solidariamente responsables del cumplimiento de los siguientes requisitos:
El director técnico del establecimiento debe practicar los ensayos y comprobaciones para determinar la pureza de los productos y continentes que se utilicen en los procesos de elaboración o fraccionamiento. Será también responsable de corroborar la calidad de los productos elaborados o fraccionados, para que se ajusten a las normas de los productos autorizados, y de asegurar su adecuada conservación.
Prescripción y expendio
El decreto 150/92 declaró obligatorio el uso de los nombres genéricos en: todos los textos normativos, inclusive registros y autorizaciones relativos a la elaboración, fraccionamiento, comercialización o importación de medicamentos; rótulos, prospectos o cualquier documento utilizado por la industria farmacéutica para información médica o promoción de las especialidades medicinales; las adquisiciones que sean realizadas por o para la administración pública nacional.
Los profesionales autorizados a prescribir medicamentos pueden optar libremente por hacerlo por el nombre genérico o la marca comercial del producto.
En los centros de expendio de medicamentos se debe tener a disposición del público el listado de especialidades medicinales registradas, agrupadas según genéricos autorizados, indicando los precios de venta.
Las farmacias, en los casos que cuenten con laboratorio acreditado ante la autoridad sanitaria, están autorizadas a comprar medicamentos a granel y en envase de tipo hospitalario para realizar el fraccionamiento para la venta.
Para el expendio todos los medicamentos deben tener en su rótulo el nombre genérico en igual tamaño y realce que el nombre de fábrica o comercial.
Comercio exterior
La exportación de especialidades medicinales y otros productos de la industria farmacéutica esta liberada, la importación también.
Laboratorios, droguerías, farmacias, obras sociales con farmacias propias y los organismo públicos de salud que lo soliciten están autorizados a importar especialidades medicinales inscriptas en el registro de la autoridad sanitaria nacional.
La condición es que el importador cuente con laboratorio de control de calidad propio debidamente equipado y con un director técnico universitario, farmacéutico con título habilitante, que deberá asegurar las condiciones higiénico sanitarias, de calidad y acondicionamiento y también eliminar los productos que no reúnan las cualidades exigidas por la autoridad sanitaria.
La responsabilidad por los medicamentos o drogas importadas es igual y solidariamente compartida por el importador y el director técnico.
Los productos importados a granel podrán ser reenvasados para su expendio y venta siempre que la unidad mínima de reempaque respete la hermeticidad del continente de origen. El fraccionamiento tiene que hacerse en laboratorios que cumplan con las normas vigentes.
Edmundo L. Sammartino
Medicamento: Toda preparación o producto farmacéutico empleado para la prevención, diagnóstico y/o tratamiento de una enfermedad o estado patológico, o para modificar sistemas fisiológicos en beneficio de la persona a quien se le administra.
Principio activo o droga farmacéutica: Toda sustancia química o mezcla de sustancias relacionadas, de origen natural o sintético, que poseyendo un efecto farmacológico específico, se emplea en medicina humana.
Nombre genérico: Denominación de un principio activo o droga farmacéutica o, cuando corresponda, de una asociación o combinación de principios activos a dosis fijas, adoptada por la autoridad sanitaria nacional o, en su defecto, la denominación común internacional de un principio activo recomendada por la Organización Mundial de la Salud.
Especialidad medicinal o farmacéutica: Todo medicamento, designado por un nombre convencional, sea o no una marca de fábrica o comercial, o por el nombre genérico que corresponda a su composición y contenido, preparado y envasado uniformemente para su distribución y expendio, de composición cuantitativa definida, declarada y verificable, de forma farmacéutica estable y de acción terapéutica comprobable.
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) es el órgano de contralor del cumplimiento de las normas vigentes para medicamentos. También mantiene actualizada la lista de especialidades medicinales o farmacéuticas autorizadas y controla las instalaciones de los lugares donde se fabrican, fraccionan o importan medicamentos.
Todo medicamento debe pasar por este organismo para su aprobación. Toda la información referente a la ANMAT está disponible en internet en: http://www.anmat.gov.ar