ปฏิกิริยาไฟฟ้าเคมี
เซลล์ไฟฟ้าเคมีที่เกิดปฏิกิริยาเคมีแล้วให้กระแสไฟฟ้า ตัวอย่างเช่น เซลล์ไฟฟ้าเคมี ถ่านไฟฉาย แบตเตอรี่รถยนต์ และเซลล์เชื้อเพลิงที่มนุษย์อวกาศใช้ใน การเดินทางไปสำรวจดวงจันทร์(เกิดปฏิกิริยาเคมี ได้กระแส)
การสร้างเซลล์กัลวานิก
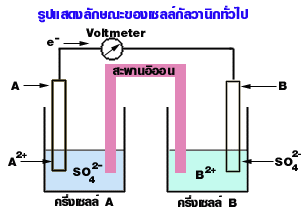
นำโลหะต่างชนิดกันจุ่มในภาชนะทีบรรจุสารละลายที่มีอิออนของโลหะนั้น เช่น โลหะ A จุ่มใน A2+ และโลหะ B จุ่มใน B2+ เป็นต้น และภาชนะ 2 ใบนี้มีสะพานอิออนเชื่อมถึงกัน แล้วต่อลวดตัวนำจากขั้วทั้งสองเข้ากับโวลต์มิเตอร์ (volt meter) ซึ่งมีเข็มแสดงทิศทางการไหลของอิเล็กตรอน พบว่าเข็มกระดิกแสดงว่าอิเล็กตรอนไหล

จากรูปพบว่าเข็มของโวลต์มิเตอร์เบนจาก A ไปยัง B แสดงว่าอิเล็กตรอนไหลจาก A ไปยัง B เราต้องการทราบสิ่งต่อไปนี้
1. ขั้วบวกและขั้วลบ
1.1 ขั้วบวก คือ ขั้วที่มีอิเล็กตรอนหนาแน่นน้อยกว่า หรือขั้ว e ไหลเข้า ได้แก่ ขั้ว B
1.2 ขั้วลบ คือ ขั้วที่มีอิเล็กตรอนหนาแน่นมากกว่า หรือขั้ว e ไหลออก ได้แก่ ขั้ว A
2. ขั้วแอโนด (Anode) และขั้วแคโทด (Cathode)
2.1 แอโนด คือขั้วที่เกิดปฏิกิริยาออกซิเดชัน ได้แก่ ขั้ว A เพราะให้ e
2.2 แคโทด คือขั้วที่เกิดปฏิกิริยารีดักชัน ได้แก่ ขั้ว B เพราะรับ e
3. แผนภาพเซลล์กัลวานิก เขียนได้ดังนี้
3.1 เขียนครึ่งเซลล์แอโนดไว้ทางซ้าย ครึ่งเซลล์แคโทดไว้ทางขวา คั่นกลางด้วยสะพานอิออน ซึ่งใช้เครื่องหมาย || หรือ //
3.2 สำหรับครึ่งเซลล์แอโนดและแคโทดเขียนอิเล็กโทรดไว้ซ้ายสุดและขวาสุด ภายในครึ่งเซลล์ถ้าต่างวัฏภาคกันใช้เครื่องหมาย / คั่น
3.3 สารละลายที่ทราบความเข้มข้นให้เขียนระบุไว้ในวงเล็บ
3.4 ถ้าครึ่งเซลล์ที่เป็นก๊าซให้ระบุความดันลงในวงเล็บด้วย
ตัวอย่าง การเขียนแผนภาพเซลล์ไฟฟ้าเคมี
1. A | A2+(aq) || B2+(aq) | B หรือ A | A2+ || B2+ | B
2. Zn | Zn2+(0.1 M) || Cu2+(0.1 M) | Cu
3. Pt | H2(1 atm) | H+(1 M) || Cu2+ | Cu(s)
4. ปฏิกิริยาที่เกิดในเซลล์ไฟฟ้าเคมี
ปฏิกิริยาครึ่งเซลล์
4.1 แอโนด เกิดปฏิกิริยา Oxidation
4.2 แคโทด เกิดปฏิกิริยา Reduction
ปฏิกิริยาทั้งเซลล์ เป็นปฏิกิริยา Redox
5. สมการแสดงปฏิกิริยา
สมการแสดงปฏิกิริยาครึ่งเซลล์
แอโนด (Oxidation) A ----> A2+ + 2e ........(1)
แคโทด (Reduction) B2+ + 2e ------> B ........(2)
สมการแสดงทั้งเซลล์เป็น Redox (ทำให้ e หมดไป) (1) + (2)
6. สารใดให้อิเล็กตรอนง่ายกว่าหรือเป็นตัวรีดิวซ์ดีกว่า โลหะ A > โลหะ B
7. สารใดเป็นตัวชิงอิเล็กตรอนดีกว่าหรือเป็นตัวออกซิไดซ์ดีกว่า B2+ > A2+
8. ศักย์ไฟฟ้าใครสูงกว่า ศักย์ไฟฟ้าที่ขั้วบวกสูงกว่าศักย์ไฟฟ้าที่ขั้วลบคือ B > A ดังนั้น กระแสจะไหลจาก B ไปยัง A สวนทางกับการเคลื่อนที่ของอิเล็กตรอน
ความต่างศักย์ = ศักย์ที่ขั้วบวก - ศักย์ที่ขั้วลบ
9. เข็มจะไม่กระดิกในกรณีที่ศักย์ทั้งสองขั้วเท่ากัน