|
M Cl + e- M + X |
1- A ligação iônica
Uma ligação iônica envolve forças eletrostáticas que atraem íons de cargas opostas. Esse tipo de ligação geralmente ocorre entre um átomo ou agrupamento de átomos que tem tendência a ceder elétrons e um átomo ou agrupamento de átomos que tem tendência a receber elétrons. Os compostos iônicos em geral apresentam altos pontos de fusão e ebulição, são sólidos duros e quebradiços e solubilizam-se facilmente em solventes polares.
Podemos exemplificar a ligação iônica com um caso típico entre dois átomos hipotéticos - um metal M e um ametal X: como M é um metal, sua energia de ionização é baixa, isto é, é necessário pouca energia para remover um elétron do átomo M. A perda de um elétron por um átomo leva à formação de um íon positivo (cátion). Por outro lado, como X é um ametal, sua afinidade eletrônica é negativa, isto é, possui uma grande tendência em ganhar elétrons e formar um íon negativo (ânion). Se estes processos são interligados, ou seja, se o elétron perdido por M é ganho por X, então todo o processo pode ser representado por:
|
M Cl + e- M + X |
2- A formação de um composto iônico
A energia de ionização e a afinidade eletrônica são estabelecidas partindo de átomos isolados, no estado gasoso. No entanto, os processos que envolvem a formação de íons gasosos geralmente não são encontrados. Assim, vamos considerar a formação de cloreto de bário a partir dos estados físicos em que as substâncias bário e cloro são normalmente encontradas. Os processos envolvidos podem ser sintetizados num esquema denominado ciclo de Born-Haber. Veja:

DHs
-
Entalpia de sublimação
DHd -
Entalpia de dissociação
DHei -
Energia de
ionização
DHae -
Afinidade
eletrônica
DHUo -
Energia
reticular
A etapa em que se cristaliza o cloreto de bário é altamente exotérmica, e a energia reticular liberada (DHUo) constitui a força motriz responsável pela formação de BaCl2 sólido a partir de seus elementos no estado natural.
3- A ligação covalente
A ligação covalente consiste no compartilhamento de pares eletrônicos entre dois átomos e pode ser representada por meio da estrutura de Lewis, na qual se distribui os elétrons da camada de valência em torno de cada átomo da ligação. Os elétrons podem também ser substituídos por traços que representam os pares eletrônicos compartilhados. Veja alguns exemplos:

As diferentes cores usadas para os elétrons de cada átomo acima são importantes para indicar a origem dos elétrons na ligação, isto é, a qual átomo pertence cada elétron do par. A estrutura de Lewis procura mostrar a validade da chamada regra do octeto, que diz que os átomos tendem a se estabilizar completando sua camada de valência com oito elétrons, assemelhando-se à configuração eletrônica de um gás nobre. Tal regra pode ser útil para explicar a formação dos compostos de elementos representativos, mas não se aplica aos elementos de transição. Entretanto, mesmo no grupo de compostos de elementos representativos, existem diversos casos que não seguem a regra do octeto.
Por exemplo, considerando a molécula PCl5, na qual o átomo de fósforo é ligado por covalência a cinco átomos de cloro. O número total de elétrons de valência para o fósforo nesse caso é 10, e não 8, como previa a regra do octeto. Os orbitais ocupados pelos cinco pares são o orbital 3s, os orbitais 3p e um orbital 3d. Nesse caso, dizemos que a camada de valência se expandiu, de maneira a acomodar os cinco pares de elétrons. Essa expansão só é possível em átomos que possuem orbitais nd ou (n-1)d que podem ser usados além dos orbitais ns e np. A camada de valência dos elementos do primeiro e segundo períodos não pode ser expandida, porque não existem 1d e 2d e os orbitais 3d não são disponíveis, pois apresentam energia muito alta.
As ligações covalentes comuns são efetuadas de maneira que cada átomo contribui com um elétron do par compartilhado. No entanto, quando um átomo não pode mais efetuar ligações covalentes por já ter atingido o seu octeto, pode, se ainda houverem pares disponíveis, efetuar ligações covalentes coordenadas ou dativas, em que o par eletrônico é cedido por apenas um dos átomos da ligação. Essa ligação é feita para completar o octeto do átomo que ainda precisa se estabilizar, e costuma-se representá-la por uma seta, partindo do átomo que cede o par eletrônico para o átomo que o recebe. Entretanto, é importante deixar claro que uma ligação covalente coordenada não é diferente de uma ligação covalente comum. "Comum" e "coordenada" são apenas termos convenientes para indicar a origem dos elétrons do par compartilhado. Veja o exemplo abaixo:
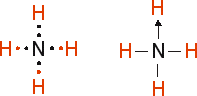
Perceba que o nitrogênio possui um par eletrônico disponível, apesar de já estar com o seu octeto completo. Esse par eletrônico pode então servir para estabilizar um outro átomo de hidrogênio, que necessita de apenas dois elétrons, adquirindo configuração eletrônica semelhante à do gás nobre hélio.
Algumas vezes não é possível representar um composto por uma única estrutura de Lewis. Consideremos a molécula de ozônio (O3), por exemplo:
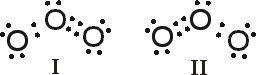
A estrutura I apresenta a dupla ligação à direita, e a estrutura II à esquerda. A representação com ambas as estruturas pode ser uma solução válida, porém, não o é, uma vez que evidências experimentais mostram que as ligações entre os oxigênios O - O são equivalentes. Uma ligação dupla é tipicamente mais forte e mais curta que uma ligação simples entre os mesmos átomos. No O3 ambas as ligações possuem a mesma força, e cada uma tem o comprimento de 0,128 nm. Como as estruturas I e II nos levam a esperar uma ligação mais curta que a outra, nenhuma serve para representar a estrutura de Lewis do ozônio. A estrutura da molécula de ozônio é conhecida como um híbrido de ressonância das estruturas I e II e não pode ser representada satisfatoriamente por uma simples estrutura de Lewis. Cada ligação oxigênio-oxigênio não é simples nem dupla, mas intermediária entre essas duas.
6- Eletronegatividade, Polaridade e Energia de ligação
Numa ligação covalente, o par eletrônico é compartilhado entre dois átomos. Isto significa que o par é atraído simultaneamente para o núcleo de ambos os átomos, resultando numa competição pelos elétrons. A atração exercida por um átomo sobre o par de elétrons na sua camada de valência depende da carga nuclear efetiva (a carga nuclear menos o efeito de blindagem das camadas internas) e da distância entre os núcleos e a camada de valência. Esta atração é medida por uma quantidade chamada eletronegatividade, que é definida como a tendência relativa de um átomo em atrair o par de elétrons da ligação. Quando os átomos ligados por covalência são idênticos não há diferença de eletronegatividade, portanto, ambos os átomos atraem o par eletrônico com a mesma intensidade. Nesse caso, dizemos que a ligação é covalente não-polar. Se houver diferença de eletronegatividade entre dois átomos, a ligação será covalente polar, pois o par eletrônico estará distribuído assimetricamente, mais próximo do átomo mais eletronegativo.
O conceito de polaridade também é útil para descrevermos moléculas que exibem uma separação parcial de cargas. Uma molécula não-polar é aquela em que a posição média de todas as cargas positivas coincide com a posição média de todas as cargas negativas. Numa molécula polar existe uma separação de cargas, ou seja, os dois centros de carga não coincidem. Tomemos como primeiro exemplo, a molécula de hidrogênio (H - H): os centros de carga positiva são os dois núcleos. O par eletrônico compartilhado está igualmente distante de ambos, ou seja, se traçarmos um plano que divida a molécula exatamente ao meio, teremos duas metades com um núcleo e um elétron. Isso significa que entre os dois átomos de hidrogênio não existe diferença de eletronegatividade, portanto, o par eletrônico é igualmente atraído pelos dois átomos. A molécula é apolar.
A situação é diferente na molécula de cloreto de hidrogênio (H - Cl): agora os centros de carga não coincidem. O centro de cargas negativas se encontra mais próximo do átomo de cloro, que é mais eletronegativo. Se traçarmos um plano que divida a molécula exatamente ao meio, teremos duas metades diferentes. Uma com o núcleo do hidrogênio e outra com o núcleo do cloro e com o par eletrônico compartilhado. Isso significa que, apesar da molécula ser eletricamente neutra, existe um pólo positivo e um pólo negativo. Dizemos que a molécula é polar, ou um dipolo.
A polaridade de uma molécula diatômica depende exclusivamente da polaridade de sua ligação. No entanto, em moléculas poliatômicas é preciso levar em conta não só a polaridade de suas ligações, mas também a sua geometria. Consideremos, por exemplo, a molécula de dióxido de carbono (O=C=O): pelo método VSPER podemos predizer que a molécula é linear. (O número estérico do carbono é 2 e não há pares isolados). Entretanto, apesar de todas as ligações carbono-oxigênio serem polares, o CO2 é uma molécula apolar. Isto se deve ao fato do deslocamento da carga eletrônica (em direção ao átomo mais eletronegativo) em uma ligação ser exatamente compensada pelo correspondente deslocamento na outra ligação. Trata-se de uma simples observação da resultante entre vetores. Nestes casos, dizemos que o momento dipolar da molécula é zero. Nas moléculas polares o momento dipolar é diferente de zero.
Para identificar se uma molécula é polar ou apolar, pode-se utilizar de uma regra prática: Se o número de pares eletrônicos ao redor do átomo central (incluindo os ligantes) for igual ao número de átomos iguais ligados a ele, a molécula será apolar. Caso estes número não coincidam, a molécula será polar. (As ligações dativas, duplas e triplas devem ser contadas como apenas um par eletrônico). Veja alguns exemplos:
| CCl4 | 4 pares eletrônicos e 4 átomos iguais | apolar |
| CHCl3 | 4 pares eletrônicos e 3 átomos iguais | polar |
| SO3 | 3 pares eletrônicos e 3 átomos iguais | apolar |
| HCN | 2 pares eletrônicos e 0 átomos iguais | polar |
| BF3 | 3 pares eletrônicos e 3 átomos iguais | apolar |
| H2O | 4 pares eletrônicos e 2 átomos iguais | polar |
| NH3 | 4 pares eletrõnicos e 3 átomos iguais | polar |
OBS: Toda substância simples é apolar.
A força de uma ligação química é medida pela energia necessária para rompê-la. Uma ligação forte apresenta uma energia de ligação alta. Essa energia é geralmente positiva e é expressa em kJ/mol, ou seja, a energia necessária para a dissociação de um mol de ligações. Apesar dos esforços, é muito difícil medir a energia de ligação de moléculas com mais de dois átomos. Além da dificuldade de se obter dados exatos, a força de ligação entre dois átomos é influenciada pelos outros átomos que estão ligados a eles. Assim, uma energia de ligação média é obtida tirando-se a média das energias de ligação feitas com compostos diferentes que contêm a ligação em questão.
7- A ligação metálica
Num sólido, os átomos estão dispostos de maneira variada, mas sempre próximos uns aos outros, compondo um retículo cristalino. Enquanto certos corpos apresentam os elétrons bem presos aos átomos, em outros, algumas dessas partículas permanecem com certa liberdade de se movimentarem no cristal. É o que diferencia, em termos de condutibilidade elétrica, os corpos condutores dos isolantes. Nos corpos condutores muitos dos elétrons se movimentam livremente no cristal, de forma desordenada, isto é, em todas as direções. E, justamente por ser caótico, esse movimento não resulta em qualquer deslocamento de carga de um lado a outro do cristal.
Aquecendo-se a ponta de uma barra de metal, colocam-se em agitação os átomos que a formam e os que lhe estão próximos. Os elétrons aumentam suas oscilações e a energia se propaga aos átomos mais internos. Neste tipo de cristal os elétrons livres servem de meio de propagação do calor - chocam-se com os átomos mais velozes, aceleram-se e vão aumentar a oscilação dos mais lentos. A possibilidade de melhor condutividade térmica, portanto, depende da presença de elétrons livres no cristal. Estudando-se o fenômeno da condutibilidade elétrica, nota-se que, quando é aplicada uma diferença de potencial, por meio de uma fonte elétrica às paredes de um cristal metálico, os elétrons livres adquirem um movimento ordenado: passam a mover-se do pólo negativo para o pólo positivo, formando um fluxo eletrônico orientado no interior do metal. Quanto mais elétrons livres no condutor, melhor a condução se dá.
Os átomos de um metal têm grande tendência a perder elétrons da última camada e transformar-se em cátions. Esses elétrons, entretanto, são simultaneamente atraídos por outros íons, que então o perdem novamente e assim por diante. Por isso, apesar de predominarem íons positivos e elétrons livres, diz-se que os átomos de um metal são eletricamente neutros.
Química 2000 - Wagner Xavier Rocha, 1999