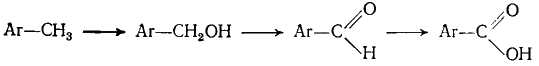[Содержание]
[index]
|
6. Окисление и дегидрирование
6.1. Общие закономерности
[6.2. Окисление метильных и метиленовых групп]
6.1. Общие закономерности
Окисление-это отнятие электронов, например:
| Fe2+ = Fe3+ + e |
(Г.6.1) |
Поэтому окислителями являются соединения, обладающие сильным сродством к электрону (электрофильностью). Напротив, соединение окисляется тем легче, чем больше у него тенденция к
отдаче электронов (нуклеофильность).
Согласно этому определению окислителями могут служить следующие сильноэлектрофильные реагенты: азотная кислота, кислород и перекисные соединения (перекись водорода, перекиси металлов, неорганические и органические надкислоты), сера, двуокись
селена, хлор, бром, кислородные кислоты галогенов-гипохлориты
и гипобромиты, хлорная кислота, йодная кислота, соединения металлов в высших степенях окисления [например, соединения железа (III), двуокись марганца, перманганат калия, хромовая кислота и ее ангидрид, двуокись свинца, тетраацетат свинца].
Легкость окисления субстрата возрастает вместе с ростом его
нуклеофильности, что соответствует следующим рядам:
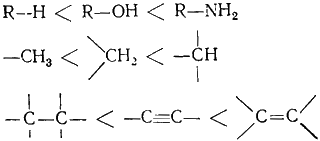 |
(Г.6.2) |
Окисляемость органического соединения обычно связана с наличием соответствующего атома водорода: окисление идет с отщеплением водорода или присоединением кислорода. Так, например, толуол окисляется до бензальдегида и далее до бензойной
кислоты:
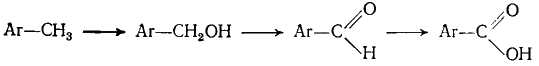 |
(Г.6.3) |
По этой причине легко окисляется муравьиная кислота - подобно всем альдегидам и в отличие от других карбоновых кислот:
 |
(Г.6.4) |
Третичные спирты, напротив, вовсе не окисляются, если только
не созданы условия, в которых идет деструкция молекулы.
Не всегда ясно, осуществляется ли при окислении отдача двух электронов
одновременно (т. е. по ионному механизму) или в форме двух одноэлектронных
шагов (т.е. по радикальному механизму). При окислении углеводородов молекулярным кислородом в присутствии ионов тяжелых металлов радикальный
механизм можно считать доказанным (cм. ниже).
Особым случаем окисления является дегидрирование - отнятие
водорода (точнее, двух электронов и двух протонов).
В живой клетке с помощью цепи сопряженных друг с другом ферментативных окислительно-восстановительных реакций осуществляется перенос водорода
от субстрата к молекулярному кислороду. Относительно этих вопросов см.
учебники, в которых освещены биологически важные процессы гидрирования - дегидрирования, которые осуществляются с помощью амида никотиновой кислоты (в козимазе), лактофлавина (в желтом окислительном ферменте) и цитохромов.
[6.2. Окисление метильных и метиленовых групп]

|