

答は左の通りです。
水素は略す習慣がありますから、 と書く事が多いです。
と書く事が多いです。
単結合と二重結合が交互に繋がった、環状構造なんですね。
・・・・・
と、そうだったら話は簡単なんですが、実はそれは間違いです。
いや、「構造式の書き方」はあっています。「構造式を書け」と言われたら、図のように書いて下さい。(後で説明する、もう一つの書き方でもOK)
「書き方」としては良いんですが、現実として「単結合と二重結合が交互に繋がった環状構造」として存在している訳ではありません。
というのはですね・・・・。
不自然じゃありませんか? 二重結合と単結合が交互に存在するなんて。
不平等じゃないですか。全体的に対象図形なのに、Cを繋ぐ6個の結合に差があるのは、平等でなくてなんとなくおかしい・・・。
その感覚は、とても大切です。そして当たりです。
ここで、電子軌道を考えて見てください。
二重結合を書いたことから分かりますように、六つの炭素はそれぞれsp2混成軌道を採っています。
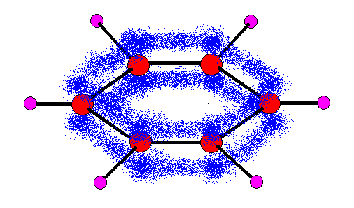
じゃぁ、6つの炭素を環状に配置して、sp2を書いてみましょう。
π結合は隣どうし繋がっているより、全部繋がっている方が自然ではないでしょうか?
そうなんですね、構造式では便宜上、二重結合と単結合が交互に存在するような構造式を書きますが、実際には同じ強度の結合が6個あるのです。
じゃあ、こいつらは全部二重結合なのかな?
そうはならないんですよ。
「二重結合と単結合が交互に存在する」の代わりなので、全ての結合は「二重結合と単結合の中間状態」なんです。
強度や結合距離とも、二重結合より弱く、単結合より強いのです。
こういう構造を採っているため、ベンゼンには独特な性質がたくさんあります。
詳しい話は、次のページでしましょう。
環状炭化水素:独学ための有機化学の「次のページ」へ:独学ための有機化学へ:目次へ