|
|
|
|
|
|
Los anticuerpos anti-citoplasma del neutrófilo o ANCA han
sido descritos como autoanticuerpos presentes en diversas enfermedades
autoinmunes. Estos anticuerpos han sido y son actualmente una herramienta
básica en el estudio de un subgrupo de enfermedades autoinmunes de
afectación vascular, las vasculitis de pequeño vaso ANCA-asociadas. En
ellas se ha incluido la Granulomatosis de Wegener
(GW), la
poliangeítis microscópica (PAM) y el síndrome de Churg-Strauss
(CH-ST). El papel
preciso del ANCA en la patogenia de estas enfermedades todavía no ha sido
totalmente resuelto. |
ANCA y
antígenos
|

|
Los ANCA son autoanticuerpos dirigidos contra estructuras
propias del cuerpo humano y presentes en el suero de determinados
pacientes. En la actualidad, se han descrito como mínimo seis
autoantígenos que servirían de diana. Todos ellos son proteínas que
presentes en las células del organismo humano no generan respuestas
inmunológicas, pero que en ciertas condiciones podrían llegar a ser
reconocidas como estructuras extrañas contra las que desarrollar una
respuesta. Se trata de enzimas azurófilos, algunos de ellos con una
estructura homóloga y muy conservada. Se localizan en los gránulos
azurófilos de los leucocitos polimorfonucleares, destacando los enzimas
proteínasa-3 (PR3) y la mieloperoxidasa
(MPO). |
-La PR3, también llamada p29 o mieloblastina, es una molécula de un
peso molecular aproximado de 29 kD. Posee una actividad enzimática hacia la
elastina, la fibronectina y otras proteínas de la membrana basal como el
colágeno de tipo IV y la laminina. También está descrita su capacidad para
procesar la interleukina-8 (IL-8), una citokina con capacidad quimioatrayente de
leucocitos polimorfonucleares, a una forma quimiotácticamente más potente, y de
romper la proteína hsp28.
-La MPO es una proteína homodimérica con dos cadenas pesadas (58
kD) y dos ligeras (16kD) con actividad peroxidasa.
Diversos autores describieron estas proteínas como los antígenos
diana de los ANCA en las dos principales vasculitis ANCA-asociadas que se
conocen hasta ahora. Aquellas personas que sufren de GW poseen unos niveles
elevados de ANCA anti-PR3. Por otro lado, los que sufren de PAM suelen presentar
unos niveles séricos de ANCA anti-MPO anormalmente altos. Sin embargo,
últimamente se ha venido descubriendo la existencia de ANCA con especificidad
hacia otros antígenos presentes en el suero de enfermos con vasculitis. Estos
antígenos son también enzimas azurófilos como la azurocidina, la catepsina G, la
elastasa o la proteína inductora de la permeabilidad bacteriana (BPI). Su
presencia en el suero de estos pacientes todavía no está muy
estudiada.
|

P-ANCA. Micrografía a 400 aumentos |
|
Hasta ahora, la técnica más común de determinación de los
ANCA es el análisis por inmunofluorescencia
indirecta. En este
método, una muestra sérica se pone en contacto con una preparación de
leucocitos polimorfonucleares previamente fijados con etanol o formalina.
Después de varios lavados y una incubación con un anticuerpo secundario
fluoresceinado, se observa la preparación bajo un microscopio óptico de
fluorescencia. Una persona experta puede llegar a reconocer dos tipos de
patrones de fluorescencia diferentes, uno perinuclear (P-ANCA), otro
citoplasmático (C-ANCA). El patrón P-ANCA corresponde con un alto
porcentaje de fiabilidad al tipo de ANCA con especificidad PR3
(ANCA-PR3). |
Sin embargo, el patrón P-ANCA es más difícilmente clasificable.
Posiblemente coincidirá con el tipo ANCA anti-MPO, aunque no se pueden descartar
los casos anti-BPI, anti-catepsina-G, anti-elastina, etc. que también presentan
este patrón. En consecuencia, y para discriminar exactamente el tipo de ANCA con
el que se puede tratar en el laboratorio hemos de recurrir a métodos de
detección más precisos. El ensayo inmunoenzimático ELISA nos proporciona el
grado de especificidad buscado.
|
Mediante este método, recubrimos una placa
con el antígeno de elección, en este caso es la proteína MPO, añadimos la
muestra de suero y tras varios lavados, incubación con un anticuerpo
conjugado y una fase de revelado, podemos llegar a determinar con
precisión la presencia o ausencia del anticuerpo ANCA-MPO en suero. De
igual modo, podemos llegar a realizar un análisis
semicuantitativo.
Sin embargo, incluso un análisis como éste
puede llegar a generar discordancias y falta de correlación entre la
presencia de ANCA-MPO y el antígeno de la placa. Diversas hipótesis se han
propuesto para explicar este fenómeno: |
|

C-ANCA. Micrografía a 400 aumentos |
-El proceso de recubrimiento de MPO en la placa puede provocar
cierta pérdida de los epítopos que reconoce el ANCA en la proteína. Éstos pueden
quedar ocultos contra la superficie de la placa, impidiendo la interacción con
el ANCA.
-Recientes estudios han confirmado la importancia de los epítopos
conformacionales ante los meramente configuraciones en la interacción ANCA-MPO.
En consecuencia, cualquier proceso que altera las características
tridimensionales de la proteína puede afectar a la antigeneicidad de la
proteína.
-La propia homología de la MPO con otras proteínas de los gránulos
azurófilos puede provocar cierto grado de reconocimiento inespecífico por parte
de los ANCA.
-El proceso de purificación de la MPO parte de los gránulos
azurófilos de leucocitos humanos. Sin embargo, diversos autores han demostrado
que estos “purificados” comerciales contienen impurezas de otras proteínas
de estos gránulos. De ello, se deducen interacciones no deseadas como ANCA
anti-BPI o ANCA anti-elastasa, por ejemplo.
En consecuencia, tests de ELISA con especificidad para cada una de
las proteínas antigénicas de los ANCA son necesarios. En estos tests se
determina la presencia sérica de ANCA contra PR3, MPO, catepsina G, elastasa,
BPI o azurocidina.
La patogenia de los ANCA
en las vasculitis ANCA asociadas
Aunque los ANCA son una herramienta básica en el diagnóstico de las
vasculitis ANCA-asociadas, su papel preciso aún está por esclarecer. Hasta el
momento, la investigación se ha dirigido al estudio del efecto del ANCA en la
estimulación del leucocito polimorfonuclear. Aunque, su papel en la activación
de otras poblaciones celulares como monocitos y células endoteliales es
reconocido.
La acción del ANCA
sobre los leucocitos polimorfonucleares
Cuando se produce un
fenómeno inflamatorio, como puede ser el asociado a una infección, los
leucocitos polimorfonucleares (PMN) estimulados por linfoquinas de los
macrófagos (IL-1, IL-6, IL-8, TNF) o productos bacterianos (LPS) se transforman
en PMN activados. Como resultado de esta activación se produce una liberación
extracelular de enzimas lisosómicos entre los que destacan la PR3 y la MPO.
Estos enzimas antes de liberarse sufren un proceso de translocación desde los
gránulos lisosomales hasta la superficie de la membrana celular. Si esto ocurre en presencia de ANCA se produce
un proceso de amplificación de la activación leucocitaria comentada que se
inicia con el reconocimiento del antígeno (PR3 o MPO) por parte del ANCA a
través del fragmento Fab de este anticuerpo. Posteriormente el complejo
antígeno-anticuerpo, que se forma en la superficie del neutrófilo, es
internalizado y como consecuencia de ello se produce un gran proceso de
estimulación por el cual se sintetizan y liberan gran cantidad de enzimas
lisosómicos y de radicales libres oxígeno que tienen gran capacidad necrotizante
y bactericida, y que iniciarán el daño endotelial.

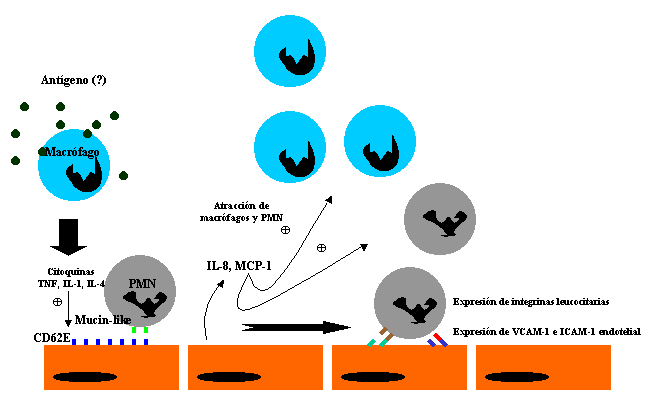
La hipótesis de activación endotelial. ¿Acción del ANCA sobre
el endotelio vascular?
La célula endotelial no es un elemento pasivo sino una célula muy
activa dentro del contexto del fenómeno inflamatorio propio de las vasculitis
ANCA-asociadas. Su actividad radica en la liberación de citokinas capaces de
atraer células implicadas en la respuesta inmune como macrófagos (vía MCP-1) o
leucocitos polimorfonucleares (vía IL-8). Asimismo es capaz de responder a la
presencia de citokinas séricas en el medio expresando moléculas de adhesión en
su superficie celular, favoreciendo la infiltración leucocitaria. Finalmente
parece posible que la célula endotelial pueda post-activarse en respuesta a la
acción de los ANCA. Existen datos preliminares que demuestran que el ANCA con
especificidad PR3 es capaz de inducir la sobreexpresión de moléculas de adhesión
(E-selectina, ICAM-1, VCAM-1) en el ámbito de la célula endotelial. La diana que
reconocen estos ANCA en la superficie endotelial, así como el mecanismo por el
cual induce la expresión de estas moléculas de adhesión, es hasta ahora
desconocido. Algunos autores postulan que el ANCA anti-PR3 reconoce la presencia
de PR3 en la superficie de la célula, que en situaciones de previa activación
por citokinas pasaría del citoplasma a la superficie de la célula ya fuese a la
membrana o la matriz extracelular. En cambio, otros autores han negado la
existencia de PR3 en la célula endotelial invalidando esta vía de
reconocimiento. Estos autores postulan que la presencia de niveles séricos
elevados de PR3 pueden llegar a favorecer la adhesión pasiva del antígeno
circulante a la superficie del endotelio, llevando a la aparición de una diana
no-propia del endotelio. Independientemente del mecanismo de interacción entre
ANCA y célula endotelial parece claro que los ANCA anti-PR3 reconocen la célula
endotelial in
vitro. En definitiva, la
implicación del endotelio en la patogenia de las vasculitis podría ser estar
relacionada con:
- Expresión de citokinas pro-inflamatorias y quimioatrayentes de
células implicadas en la respuesta inmune.
- Expresión en superficie de moléculas de adhesión en respuesta a
la existencia de citokinas pro-inflamatorias en el torrente
sanguíneo.
- Expresión en superficie de moléculas de adhesión en respuesta a
la unión de los ANCA.
Estos estudios se han realizado mayoritariamente en suero de
pacientes con GW y ANCA con especificidad PR3. Se desconoce si los ANCA con
especificidad MPO u otros ANCA con especificidad contra otros antígenos del
gránulo azurófilo del leucocito polimorfonuclear soportan esta capacidad de
reconocimiento de antígenos de la superficie del endotelio y dónde se localizan
estos antígenos (en la membrana o en la matriz extracelular). También se
desconoce si los ANCA de pacientes inactivos o sin vasculitis mantienen esta
capacidad de interacción con el endotelio.
En resumen parece que el ANCA puede actuar amplificando la
estimulación leucocitaria producida por un desencadenante no caracterizado.
Algunas observaciones permiten sugerir que estos mismos anticuerpos serían
capaces de activar la célula endotelial para la expresión de moléculas de
adhesión ligandos de otras que expresaría el leucocito polimorfonuclear. Esto
contribuiría a sustentar el papel de este anticuerpo no sólo como marcador sino
también como factor patogenético y contribuiría a tener una base de conocimiento
para la búsqueda de estrategias de tratamiento más precisas que las actualmente
utilizadas basadas en la manipulación de interacciones ANCA-endotelio o en la
sustracción de los ANCA del suero mediante plasmaféresis o
inmunoadsorción.



