COMPORTAMENTO TÉRMICO DOS GASES
1.
VARIÁVEIS DE ESTADO
Todo gás é
constituído de partículas (moléculas, átomos
ou íons) que estão em contínuo movimento desordenado,
por isso ocupa sempre o volume total do recipiente que o contém.
A pressão que o gás exerce sobre uma superfície
é o efeito causado pelos choques das partículas constituintes
sobre essa superfície.
Com o aumento da temperatura, a velocidade média das partículas
constituintes do gás aumenta; a pressão aumenta se o recipiente
que contém o gás conserva o mesmo volume.
Sejam P (Pa), V (m3) e T (K), respectivamente, a pressão,
o volume e a temperatura absoluta. As variáveis P, V e T especificam
o estado de uma dada massa gasosa; por isso são denominadas variáveis
de estado.
2.
TRANSFORMAÇÕES DOS GASES
Uma dada massa sofre uma
transformação gasosa quando passa a um novo estado, isto
é, quando ocorrem variações nas grandezas P, V e T.
Há transformações mais simples, onde uma das grandezas
é fixa, modificando-se apenas as outras duas.
Transformação isotérmica é aquela
na qual a temperatura do gás é mantida constante.
T1
= T2 = Constante
Transformação isobárica é aquela na qual a pressão do gás é mantida constante.
P1
= P2 = Constante
Transformação isométrica ou isocórica é aquela na qual o volume do gás é mantido constante.
V1
= V2 = Constante
3.
GASES PERFEITOS OU IDEAIS
São aqueles que (só existem teoricamente) obedecem à risca a equação geral dos gases perfeitos.
Os gases reais apresentam comportamentos que se aproximam dos ideais quanto mais baixa for a pressão e mais alta sua temperatura.
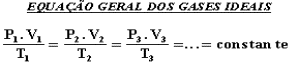
Observações:
Quando nos referimos a uma dada massa gasosa, nas transformações,
isto significa que a equação geral dos gases perfeitos só
se aplica para massa constante do gás, no estado inicial e final.
Ao se referir a condições normais de temperatura e pressão,
abreviadamente CNTP, a temperatura considerada é 273K e a pressão
de 1 atm (105 Pa).
As variáveis de estado são medidas:
T
- temperatura medida no termômetro.
V - volume do gás é o volume do recipiente.
P - pressão medida no manômetro.
Lei
de Boyle-Mariotte:
Na transformação isotérmica de uma dada massa gasosa, a pressão é inversamente proporcional ao volume.


O diagrama anterior P x V denomina-se diagrama de Clapeyron e a isoterma é o conjunto de todos os pontos de mesma temperatura.
Lei
de Charles (1ª Lei de Gay-Lussac):
 Na
transformação isobárica de uma dada massa gasosa,
o volume é diretamente proporcional à temperatura absoluta.
Na
transformação isobárica de uma dada massa gasosa,
o volume é diretamente proporcional à temperatura absoluta.

Lei
de Charles (2ª Lei de Gay-Lussac):
 Na
transformação isométrica (isocórica) de uma
dada massa gasosa, a pressão é diretamente proporcional à
temperatura absoluta.
Na
transformação isométrica (isocórica) de uma
dada massa gasosa, a pressão é diretamente proporcional à
temperatura absoluta.

EXERCÍCIOS:
1. (PUCRS) Um ás
ideal sofre uma transformação isobárica. Se a temperatura
no gás variou de 7 ºC para 21 ºC , qual é a variação
percentual de seu volume?
(A) 1%
(B) 3%
(C) 5%
(D) 7%
(E) 21%
2. (PUCRS) Se um gás perfeito, com volume inicial V, tem os
valores da pressão e da temperatura absoluta duplicados simultaneamente,
o novo volume do gás passará a ser:
(A) V/4
(B) V/2
(C) V
(D) 2V
(E) 4V
3. (PUCRS) Um motorista calibrou os pneus do seu carro à temperatura
de 27 ºC. Depois de rodar bastante, ao medir novamente a pressão,
encontrou um resultado 20% superior ao valor da calibragem inicial. Supondo
invariável o volume das câmaras, a temperatura do ar comprimido
deve ter atingido:
(A) 305 K
(B) 320 K
(C) 360 K
(D) 300 K
(E) 280 K
4. (UFRGS) A figura, abaixo, representa um recipiente cilíndrico
com um êmbolo, ambos feitos de material isolante térmico.
Não existe atrito entre o êmbolo e as paredes do cilindro.
Pendurado ao êmbolo, em equilíbrio, há um corpo suspenso
por um fio. No interior do cilindro, há uma amostra de gás
ideal ocupando um volume de 5 litros, à temperatura de 300 K e à
pressão de 0,6 atm. Em um dado momento o fio é cortado.

Quando novamente o gás se encontrar em equilíbrio termodinâmico, qual será o seu volume (V), a sua pressão (p) e a sua temperatura (T)?
(A) V > 5 litros, p > 0,6
atm, T = 300 K
(B) V < 5 litros, p > 0,6 atm, T > 300 K
(C) V < 5 litros, p > 0,6 atm, T = 300 K
(D) V < 5 litros, p = 0,6 atm, T = 300 K
(E) V > 5 litros, p < 0,6 atm, T > 300 K
5. (UFRGS) O diagrama representa a pressão p em função
do volume V de um gás ideal. Analisando o diagrama, em qual do processos
o gás NÃO sofreu variação de temperatura?

(A) De A para B
(B) De B para C
(C) De C para D
(D) De D para E
(E) De E para A
6. (UFRGS) Os pontos A,
B e C do gráfico pressão P em função do volume
V na figura indicam três estados de uma mesma amostra de um gás
perfeito.
Unidades arbitrárias de P e V.

Sendo TA , TB
e TC as temperaturas absolutas correspondentes aos referidos
estados, podemos afirmar que
(A) TC > TB > TA
(B) TC = TB = TA
(C) TC < TB = TA
(D) TC > TB = TA
(E) TC > TB = TA
7. (UFRGS) A pressão
que um gás em uma superfície é devida:
(A) ao choque entre as moléculas.
(B) à força de atração entre as moléculas.
(C) ao choque das moléculas contra a superfície considerada.
(D) à força de repulsão entre as moléculas.
(E) à força com que a superfície atrai as moléculas.
8. (PUCRS) Um gás
ideal de massa constante sofre determinada transformação
na qual a sua pressão duplica e o seu volume triplica. A temperatura
absoluta do referido gás:
(A) não muda.
(B) duplica.
(C) cai para a metade.
(D) sextuplica.
(E) triplica.
9. Um balão de aniversário,
cheio de hélio, é largado da superfície da Terra,
subindo até a altitude de 5.000 m. Durante a subida, podemos afirmar
que:
(A) o volume da bola diminui.
(B) a temperatura da bola aumenta.
(C) a pressão do gás no interior da bola aumenta.
(D) o volume da bola aumenta.
(E) o volume da bola permanece constante.
VEJA MAIS: