1. TRABALHO EM UMA TRANSFORMAÇÃO
Suponhamos um gás encerrado num cilindro dotado
de um pistão móvel, de área A, que sofre
um deslocamento DX
.
A força aplicada pelo gás, perpendicular ao cilindro,
é:
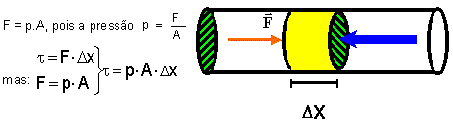
Como a área do cilindro vezes o deslocamento do mesmo é igual a variação de volume DV sofrida pelo gás resulta:
![]()
Esta expressão permite determinar o trabalho realizado pelo gás numa transformação isobárica de pressão p constante e variação de volume DV .
O trabalho pode também ser calculado através do diagrama "p x V". A área hachurada corresponde a p . DV, que é o trabalho.
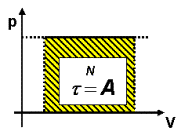
O trabalho é numericamente igual a área.
Numa
transformação cíclica:
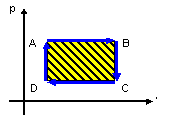

t > 0 se sentido HORÁRIO t < 0 se sentido ANTI-HORÁRIO
2. PRIMEIRO PRINCÍPIO DA TERMODINÂMICA
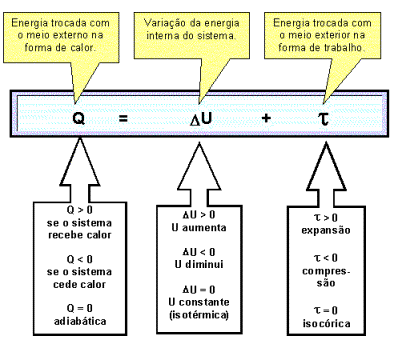 Se
um gás encerrado num cilindro recebe uma certa quantidade de calor,
usando parte para aumentar sua energia interna e parte para empurrar o
pistão, teremos que:
Se
um gás encerrado num cilindro recebe uma certa quantidade de calor,
usando parte para aumentar sua energia interna e parte para empurrar o
pistão, teremos que:

EM
RESUMO

3.
TEORIA CINÉTICA DOS GASES IDEAIS
Sabemos que as moléculas de um gás possuem
elevado grau de liberdade, em um movimento desordenado, cujas trajetórias
podem ser consideradas retilíneas no intervalo entre duas colisões.
Essas moléculas possuem as mais variadas velocidades, mas permitem
que se estabeleça uma velocidade média.
A teoria cinética dos gases estuda esse comportamento molecular
e explica, desse modo, os fenômenos da pressão, temperatura
e energia cinética do gás.
Uma conclusão importante da teoria cinética dos gases
é que a "energia cinética média das partículas
de um gás é diretamente proporcional a temperatura absoluta
do mesmo" .
Ou seja:
![]()
onde k é a constante de Boltzmann.
4. SEGUNDO PRINCÍPIO DA TERMODINÂMICA
Máquinas térmicas são dispositivos que convertem calor em trabalho e vice-versa: máquinas a vapor, motores a explosão, refrigerados, etc.
Se todo o calor absorvido por uma máquina térmica fosse integralmente transformado em trabalho, teríamos o caso ideal de rendimento cem por cento. Mas a experiência mostra que isto não é possível, o que constitui o Segundo Princípio da Termodinâmica.
Enunciado de Clausius
"O calor só pode passar, espontaneamente, de um corpo de maior para outro de menor temperatura."
Enunciado de Kelvin
"É impossível construir uma máquina térmica que, operando em ciclo, extraia calor de uma fonte e o transforme integralmente em trabalho."
Ciclo de Carnot
Ciclo teórico que permite o maior rendimento entre as máquinas térmicas. Onde Q1 é a quantidade de calor extraída da fonte quente e Q2 é a quantidade de calor perdido para o meio , o rendimento de um ciclo é dado por:
![]()
Carnot mostrou que o máximo rendimento possível entre duas temperaturas T1 e T1, depende exclusivamente dessas temperaturas, independendo da natureza do sistema que percorre o ciclo, isto é:
![]()
ou
![]()
Se T2 = 0, isto é, zero absoluto, teoricamente teríamos rendimento 100%.
EXERCÍCIOS
(A) aumenta a energia cinética média
de translação das moléculas do gás.
(B) é realizado um trabalho pelo gás.
(C) a pressão do gás diminui.
(D) a pressão do gás permanece constante
(E) ocorre uma transformação adiabática.
2. (UFRGS) Qual é a variação de energia interna de um gás ideal sobre o qual é realizado um trabalho de 80J, durante uma compressão adiabática?
(A) 80J
(B) 40J
(C) zero
(D) -40J
(E) -80J
3. (PUCRS) Durante a expansão de um gás, este realiza um trabalho de 200 J, mediante o recebimento de uma quantidade de calor equivalente a 900 J. Nessa expansão a variação da energia interna do gás é
(A) 900 J.
(B) 700 J.
(C) 500 J.
(D) 300 J.
(E) 200 J.
4. (PUCRS) O gráfico p x v representa as transformações experimentadas por um gás ideal. O trabalho mecânico realizado pelo gás durante a expansão de A até C, é em Joules
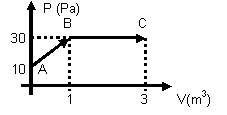
(A) 10
(B) 20
(C) 30
(D) 50
(E) 80
5. (UFRGS) O desenho mostra um cilindro de metal dotado de um êmbolo móvel em cujo interior encontra um gás ideal em equilíbrio termodinâmico
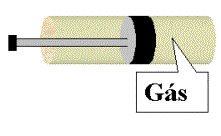
Em dado instante uma força de módulo F age sobre o êmbolo que comprime o gás rapidamente. Durante a compressão
I. ocorre um aumento de energia interna do gás.
II. o trabalho realizado pela força de módulo F produz
uma elevação da temperatura do gás .
III. o trabalho realizado pela força de módulo F é
igual a quantidade de calor que se transmite para o meio externo.
Quais estão corretas?
(A) Apenas I.
(B) Apenas II.
(C) Apenas I e II.
(D) Apenas II e III.
(E) I, II e III.
6. (UFRGS) O gráfico da pressão p em função do volume V de um gás mostra duas transformações termodinâmicas, I e II, a partir do estado inicial i. Os estados finais das duas transformações apresentam o mesmo volume (Vf), mas pressões diferentes.
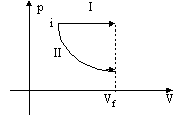
A partir do gráfico, é possível afirmar que:
(A) o trabalho realizado pelo gás na transformação
I é maior do que o realizado na transformação II.
(B) na transformação II não há trabalho
realizado.
(C) na transformação I não há variação
de energia interna do gás.
(D) a transformação II é isobárica.
(E) a transformação I é adiabática.
7. (UFRGS) Assinale a alternativa que preenche corretamente as lacunas no texto abaixo.
A função do compressor de uma geladeira é a de aumentar a pressão sobre o gás freon contido na tubulação. Devido à rapidez com que ocorre a compressão, esta pode ser considerada uma transformação __________. A temperatura e a pressão do gás se elevam. Como não há trocas de calor, o trabalho realizado pelo compressor é igual a variação da energia __________ do gás.
(A) adiabática - interna
(B) isotérmica - cinética
(C) isotérmica - interna
(D) adiabática - potencial
(E) isobárica – interna
8. (UFRGS) Um recipiente contém um gás ideal à temperatura T. As moléculas deste gás têm massa m e velocidade quadrática média v. Um outro recipiente contém também um gás ideal, cujas moléculas têm massa 3m e a mesma velocidade quadrática média v. De acordo com a teoria cinética dos gases, qual é a temperatura deste segundo gás?
(A) T/9
(B) T/3
(C) T
(D) 3T
(E) 9T
9. (UFRGS) Durante um ciclo termodinâmico, uma máquina térmica realiza um trabalho W, que é igual a Q1 - Q2 , onde Q1 é o calor extraído de uma fonte quente, e Q2 é o calor descarregado no ambiente. O rendimento dessa máquina térmica é dado por
(A) (Q1 - Q2) / Q1
(B) (Q1 - Q2) / Q2
(C) Q1 / (Q1 - Q2)
(D) Q2 / (Q1 - Q2)
(E) (Q1 + Q2) / Q2
VEJA MAIS: