[8.1.Жидкое состояние]
[8.2.Давление насыщенного пара]
[8.3.Определение молекулярной массы]
8.4.Растворы жидкостей в жидкостях
[8.4.1.Законы Рауля]
[8.4.2.Фракционная перегонка]
[8.4.3.Неидеальные растворы]
[8.5.Несмешивающиеся жидкости
Перегонка с паром]
[A-Level-8.rar.zip] Архив (127K)
[index]
8.1.Жидкое состояние
В жидкости молекулы расположены друг к другу ближе, чем в газе. Это следует из того, что 1 объем воды образуется в результате конденсации 1300 объемов пара. Образование жидкости из газа есть следствие возникновения между молекулами сил притяжения. Они должны быть значительными, чтобы преодолеть кинетическую энергию молекул. Охлаждение газа сопровождается потерей молекулами кинетической энергии до тех пор, пока они не достигнут температуры, при которой кинетическая энергия их перестанет перекрывать силы межмолекулярного притяжения, и в результате газ начинает сжижаться.
Жидкое состояние значительно ближе к твердому, чем к газообразному. Частицы в жидком состоянии удалены друг от друга на большее расстояние, чем в твердом, и менее упорядочены. Плавление твердого тела сопровождается обычно 10%-ным увеличением объема (Это утверждение не относится к таким веществам, как вода, висмут, чугун, плавление которых сопровождается уменьшением объема).
Количество теплоты, необходимой для превращения 1 моль жидкости в пар при 1 атм, называют стандартной энтальпией испарения: ∆H°исп. То же количество теплоты выделяется при конденсации 1 моль пара при 1 атм. Количество теплоты, расходуемое на превращение 1 моль твердого тела в жидкость при 1 атм, называют стандартной энтальпией плавления: ∆H°пл. То же количество теплоты высвобождается при отверждении 1 моль жидкости при 1 атм. Стандартные энтальпии плавления много меньше стандартных энтальпий испарения, поскольку переход из твердого состояния в жидкое сопровождается меньшим нарушением межмолекулярного притяжения, чем переход из жидкого состояния в газообразное.
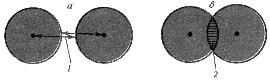
Рис. 8.1 Расстояние между молекулами жидкости:
a - расстояние между молекулами жидкости; б - воображаемое сжатие
жидкости, приводящее к большему сближению ее молекул;
1 - силы притяжения между молекулами; 2 - взаимоперекрывание электронных облаков,
приводящее к отталкиванию молекул.
Жидкостям присущ определенный объем, а сжимаемость их незначительна.
В жидкости расстояние между молекулами обусловлено балансом между силами
притяжения их и силами отталкивания соседствующих электронных облаков
(рис. 8.1). Силы межмолекулярного притяжения в жидкости меньше по
сравнению с таковыми в твердых телах, но недостаточно велики, чтобы
придать жидкости определенную форму. Именно поэтому жидкость течет и
приобретает форму содержащего ее сосуда.
Газы способны диффундировать из-за большой скорости движения их молекул. Скорость диффузии жидкостей значительно меньше, чем газов; у твердых тел она еще меньше. И хотя молекулы жидкости движутся быстро, они не могут свободно перемещаться из одной части жидкости в другую, так как их удерживают силы притяжения, которые Связывают молекулы с соседними молекулами в неплотно упакованную сетку. Изредка, однако, молекула "вырывается" из этой сетки и движется в другую область жидкости, т. е. диффундирует. Поскольку молекулы жидкости движутся постоянно, у некоторых из них энергии оказывается достаточно, чтобы улетучиться из жидкости в пар. (Понятие пар относится к газу, находящемуся при температуре ниже его критической температуры.).
Энергия улетучивающихся молекул значительно больше средней энергии и достаточна для преодоления сил притяжения другими молекулами. Энергия молекул, остающихся в жидкости, меньше энергии улетучившихся молекул, так что температура жидкости понижается.
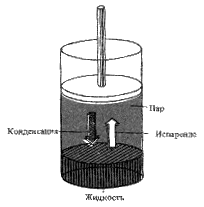
Рис. 8.2 Жидкость и ее пар достигают равновесия в замкнутом сосуде: скорости
испарения и конденсации становятся равными.
Так как доля молекул с высокой энергией по мере роста температуры увеличивается, скорость испарения также увеличивается. Испарение продолжается до тех пор, пока существует жидкость. Однако, если жидкость находится в замкнутом сосуде, молекулы пара сталкиваются со стенками сосуда; некоторые из них движутся по направлению к жидкости, а отдельные возвращаются в нее, т. е. наступает конденсация (рис. 8.2). Равновесие достигается тогда, когда скорости испарения жидкости и конденсации пара становятся равными.
[8.2.Давление насыщенного пара]
[index]