- Antiviraux: substances artificielles introduitent à l'intérieur
de l'organisme pour lutter contre les virus.
- Antivirucide: qui pourrait détruire les particules virales.
Ceci n'existe pas pour des traitement in-vivo car les particules virales sont
synthétisées par la cellule infectée elle-même.
Il existe néamoin des virucides pour usage externe (par exemple pour
les désinfection des muqueuses génitales). Mais parfois ceci
peuvent irriter la muqueuse et paradoxalement favoriser l'infection virale.
- Virostatique: on parle d'activité virostatique lorsque qu'une
substance est capable d'inhiber la multiplication virale (et non de libérer
totalement l'organisme de la présence du virus).
- Les Virostatiques
Les virostatiques réduisent la production de virus.
Pour mesurer l'efficaité d'un virostatique, on mesure sa C.I.50 (concentration
d'antiviraux nécessaire pour réduire à 50% la réplication
du virus, testé en culture de cellule).

-On calcule la concentration qui réduit de 50% le nombre de plage
(ici, CI50= 0,1)
-Il se peut qu'a une concentration de 1000, il y est des altérations
pour la cellule: dans ce cas, la concentration cytotoxique (C.C.) est
égale à 1000.
-On détermine ensuite l'indice de sélectivité, qui
permet de donner la marge de concentration d'utilisation du virostatique:
I.S.= C.C./CI50
Exemple de virostatique: L'aciclovir, qui bloque la réplication
du Herpès virus simplex (HSV).
- Les différents types d'Antiviraux
selon leurs cibles
-
Antiviraux inhibant l'attachant du virus
à la membrane plasmique: exemple du VIH
Pour pénétrer dans la cellule le virus s'attache à
la membrane plasmique.
Le VIH, par exemple, possède 2 glycoprotéine de surface, gp41
et gp120 qui permettent au virus d'intéragir avec le CD 4
du lymphocyte LT Helper.


-Il a été fabriqué un analogue de la chaine transmembranaire
CD 4 afin de bloquer la fixation du virus par sa glycoprotéine
gp120. Cet analogue a été testé sur une culture cellulaire
infectée par le VIH. Il a été montré que des
doses faibles peuvent inhiber la réplication du VIH avec un indice
de sélectivité d'environ 1000.
Il a par ailleurs été observé chez l'homme une non
toxicité de cette analogue.
Mais celà ne marchait pas sur la multiplication virale in-vivo: POURQUOI
?
En fait, le travail a été réalisé sur la souche
BRU de HIV est cette souche est passée un grand nombre de fois en
culture cellulaire et les caractéristiques de la gp120 ont été
altérées (perte de ses glycosides): la glycoprotéine
étant différente, elle était devenu beaucoup plus accessible
à l'analogue du CD 4 que la protéine
gp120 sauvage.
-Un autre polypeptide (T20) qui se fixe sur la gp41.
La gp41 détermine la fusion entre la membrane virale et la membrane
cytoplasmique.
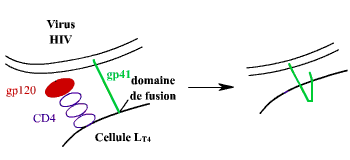
La glycoprotéine gp41 rapproche l'envellope du virus de la membrane
cytoplasmique: ce repliement peut être géné par le polypeptide
T20 qui bloque la gp120. Un traitement comportant deux piqûres par
jours est ou a été effectué sur des patients.
- Antiviraux inhibant la décapsidation du virus
Nous prendrons l'exemple des Rhinovirus.
Les rhinovirus, agents du rhume, comporte environ 100 sérotypes.
Le virus possède une capside lui permettant de résister à
l'air ambient: la décapsidation (destruction de la capside),
une fois que le virus dans la cellule, est nécessaire pour que son
ARN soit exprimé.
Une substance a été trouvée qui bloque cette décapsidation.
Cette substance est capable de contracter les liaisons covalentes entre 2
molécules de capside.
- Antiviraux inhibant la réplication du virus
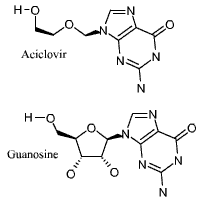
schéma de l' Acyclovir |
L'Aciclovir est un analogue de la guanosine.
Il peut être incorporé dans l'ADN en formation et bloquer
sa synthèse (effet butoir ou terminateur de chaîne)
-Il agit sur l'activité de lecture de l'ADNpol virale,
en particulier sur celle du virus HSV.
-Il possède de plus une faible affinité pour l'ADNpol
d'eucaryote, ce qui en fait un bon antivirale avec peu d'effets indésirables. |
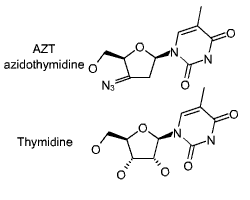
schéma de l' AZT |
L'AZT (azidothymidine) est un analogue de la Thymidine.
Son rôle comparable à celui de l' aciclovir, a ceci près
qu'il bloque la reverse trancriptase du virus HIV. |
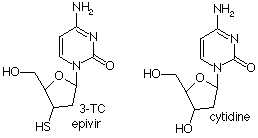
schéma de la 3-TC |
La 3TC (ou lamivudine) est un analogue de la cytidine.
La 3TC est un inhibiteur sélectif de la réplication du VIH-1 et du VIH-2
in vitro. |
|
Virus
|
Antiviraux
|
Caractéristique(s) - Rôle(s)
|
CMV
(Cytomégalovirus) |
DHPG (ou Ganciclovir Sodique) |
-Se transforme sous l'effet de kinases en ganciclovir
triphosphate capable d'inhiber de façon compétitive l'ADN polymérase
virale et donc de stopper ou de ralentir la replication du virus. |
| HIV |
didéoxynucléoside
AZT, CTV, 3TC |
-Analogues nucléosidiques.
-Ne possèdent pas de 3'OH
-Agissent sur la RNApol du Virus |
| HSV |
Activin™ |
|
| HBV |
sensible au 3TC |
-Analogue nucléosidique de la cytidine.
-La 3-TC est phosphorylée en lamivudine triphosphate qui inhibe la transcriptase
inverse et qui bloque l'élongation de la chaîne d'ADN proviral lors
de la réplication virale.
-N'aurait que peu d'effet sur l'ADN nucléaire et mitochondrial des cellules
humaines.
-Pourrait agir sur certaines souches de VIH résistantes à la zidovudine.
Inhiberait également la réplication du virus de l'hépatite B |
-Il existe également des antiviraux bloquant la réplication
des virus possédant une ARN polymérase:
Le virus HSV (Virus de l'Hépatite C) est un virus à ARN+. L'ARN
est synthétisé grâce à une ARNpol virale.
Il existe un inhibiteur de cet ARnpol, la ribavirine, qui ,convertie
en dérivés mono, di et triphosphate, inhiberaient la synthèse des acides nucléiques
viraux.
Plus exactement, cet inhibiteur s'oppose à la pose de la coiffe sur
les ARN (c'est donc un inhibiteur non spécifique). Il induit donc d'important
effets secondaires.
- Antiviraux inhibant la protéase virale
De nombreuses synthèse de protéines virales se font à
partir de précurseurs polypeptidiques (Enzymes, protéines de
capsides...)
Par exemple dans le cas du VHC, tous le génome d'ARN est traduit sous
forme d'un polypeptide géant qui est ensuite clivé en plusieurs
morceaux dont les protéines de capsides, les protéines aux propriétés
enzymatiques, les protéases virales...
Ces dernières servent justement à découper certains sites
du polypeptide géant.
Si l'on parvenait à inhiber la protéase, on posséderait
un antivirale capable de bloquer la réplication du virus.
Ceci a été trouvé pour le virus HIV (ceux sont les fameux
anti-protéases).
- Antiviraux inhibant la Neuraminidase
Le virus Influenza se fixe aux récepteurs de l’hémagglutinine (protéine de
surface) situés à la surface des cellules (récepteurs) de l’appareil respiratoire.
Ensuite, il s’introduit clandestinement à l’intérieur de la cellule hôte et
s’y reproduit.
Ici, la deuxième protéine de surface du virus, la neuraminidase, remplit
sa tâche spécifique : elle coupe des parties des récepteurs de virus (acide
neuraminique) de manière à ce que les particules de virus se libèrent de la
surface de la cellule hôte et puissent contaminer de nouvelles cellules
Elle permet donc de libérer les bourgeons.
Toutes les cellules infestées meurent petit à petit.
Les inhibiteurs de la neuraminidase, bloquent ce processus de libération
: les récepteurs de virus de la surface de la cellule hôte restent intacts
si bien que les virus suivants restent « collés » et que le cycle d’infection
est stoppé.
- Antiviraux inhibant l'intégrase
C'est une nouvelle génération d'antiviraux qui tentent d'être
synthétisé, en particulier pour la lutte contre le VIH.
(extrait du site http://www.cnrs.fr/Cnrspresse/n382a1.htm
)
"L'intégrase du VIH (virus de l'immunodéficience humaine) est
une enzyme qui catalyse l'incorporation de l'ADN proviral dans l'ADN de l'hôte,
étape cruciale du cycle de réplication du virus. Des chercheurs ont mis au
point de nouveaux inhibiteurs de l'intégrase. Ces inhibiteurs - possédant
le noyau styrylquinoléine - ont montré une excellente activité anti-intégrase
in vitro. Ils bloquent la réplication du VIH en culture cellulaire et sont
dénués de cytotoxicité. Ils ouvrent ainsi de nouvelles perspectives pour le
développement d'antiviraux destinés au traitement du Sida."
- Les obstacles à l'utilisation d'antiviraux
- La cytotoxycité
Plusieurs antiviraux sont activés par des enzymes cellulaires:
-L'ACV (Aciclovir):
C'est un nucléoside qui est activé par la Thymidine Kinase du Virus (TKV).
Il n'est donc activé que dans les cellules infectées.
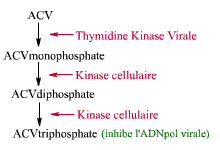
Par ailleurs, l'ACV inhibe la DNA polymérase virale de façon plus importante
que celle de la cellule hôte.
La cytotoxycité de cet antiviral reste donc faible.
-L'AZT (azidothymidine):
Le virus HIV ne possède pas de Kinase virale. L'AZT est donc phosphorylé
uniquement par des kinases cellulaires. Il s'en suit que l'AZT peut être
activé dans toutes les cellules de l'hôte infecté, même
si ces cellules ne sont pas infectées par le virus. Heureusement, l'AZT
n'agit pas sur l'ADN pol. nucléaire mais plutôt sur l'ADNpol
mitochondriale (ADNpol.g mitochondriale).
Le risque de toxicité pour l'organisme reste donc limité mais
il existe néanmoins, notamment au niveau neuronale.
-Le FIAV (Fluorio-iodo AraVridine)
Cet antiviral agit sur la transcriptase inverse virale du virus HBV (virus
de l'hépatite B) mais également sur l'ADN pol.g des mitochondries
cellulaires.
En cas de traitement, l'ativiral s'accumule est détruit les mitochondrie
(toxicité retardée). Il y a alors mort des individus traité
(il n'est donc pas prescrit...).
 plus
d'info sur les antiviraux de l'HBV? http://www.john-libbey-eurotext.fr/articles/vir/1/3/197-215/fr-resum.htm. plus
d'info sur les antiviraux de l'HBV? http://www.john-libbey-eurotext.fr/articles/vir/1/3/197-215/fr-resum.htm.
-BVaraU (Bromo-Vinyl-ara-Uridine ou sorivudine)
Cet antiviral est utilisé contre le virus de la varicelle et du zona
(VZV).
Associé au 5 FluoroUracile (5FU)* utilisé
dans les traitements cancéreux, il inhibe le catabolisme de ce dernier,
entraînant un surdosage du 5FU est donc de très forts effets
secondaires.
*(antivirale qui freine la mitose
cellulaire, prend la place de l'uracile dans les désoxyribonucléotides. en
inhibant la thymidilate synthétase (TS), empêchant la méthylation de l'acide
désoxyridylique en acide thymidylique et interfère donc dans la biosynthèse
de l'ADN. Trois métabolites actifs dérivés du 5-FU agissent : - le 5F-dTP
(fluoro-uridine triphosphate) s'incorpore dans l'ARN et inhibe la formation
et la fonction de l'ARN. - le 5F-dUMP (5 fluoro-désoxyuridine monophosphate)
se lie à la thymidilate synthétase et inhibe la formation de la déoxythymidine
triphosphate qui est un précurseur nécessaire de l'ADN. - le FdUTP est incorporé
dans le DNA et inhibe l'élongation de la chaîne de l'ADN.)
 plus
d'info sur le VZV? http://www.john-libbey-eurotext.fr/articles/vir/4/3/207-16/index.htm. plus
d'info sur le VZV? http://www.john-libbey-eurotext.fr/articles/vir/4/3/207-16/index.htm.
-Les inhibiteurs de protéases
Ces antiviraux bloques les protéases virales qui dans le cas du VIH,
permet de scinder les protéines précurseurs pour former les différentes protéines
de structure ou de régulation incluant la transcriptase inverse, l'ARNase
et l'intégrase.
Des anomalies biologiques peuvent s’associer ou non au syndrome lipodystrophique:
hyperglycémie par insulino-résistance pouvant aboutir au diabète, hypertriglycéridémie
modérée à sévère, hypercholestérolémie plus rare. La connaissance de ces anomalies
est trop récente pour que les conséquences, en particulier vasculaires, ne
soient appréciées mais des durées de traitement prolongées font craindre des
accidents cérébraux et/ou coronariens. La réversibilité de ces anomalies à
l’arrêt du traitement est incertaine, du moins pour les troubles morphologiques.
 plus
d'info sur les inhibiteurs de protéase? http://publications.crips.asso.fr/transcriptase/71_996.htm. plus
d'info sur les inhibiteurs de protéase? http://publications.crips.asso.fr/transcriptase/71_996.htm.
- Les mutations virales
Plus un antiviral est bien ciblé sur une structure ou un mécanisme
virale (donc plus il est spécifique), plus il est possible de sélectionner
des mutants résistants, d'autant que les virus (surtout ceux à
ARN qui non pas de mécanisme de réparation) mute facilement.
-Exemples de résistance aux antiviraux par mutations:
. Les virus Herpès résistant
à l'Aciclovir sont par exemple mutés sur leurs Thymidines Kinases
(T.K.-) (ce qui empêche l'activation par phosphorylation de l'aciclovir)
ou sur leurs ADNpol.
Seulement 1/10000ème des virus Herpès sont TK-. Mais ces mutants
peuvent être sélectionnés chez les sujets immuno-déprimés
traité à l'acyclovir. Il faut alors traité les patients
infecté par le virus TK- par du Foscarnet (analogue du pyrophosphate,
inhibe l'ADNpolvirale de l'HSB) qui agit directement (il n'a pas besoin d'être
phosphorylé par la TKvirale) et donc peut agir sur les virus Herpès
TK-.
. Pour le virus HIV, où les virus à ARN en générale,
ce problème de mutation des cibles des antiviraux se pose d'autant
plus que la fréquence des mutations est élevée. Le traitement
en monothérapie sélectionne très rapidement des mutants
résistants (d'où l' idée de tri-thérapie).
- Influence de la latence
Le virus, une fois la cellule infectée, peut s'intégrer dans
le génome cellulaire sans se multiplier.
-ex: le virus HIV s'intègre parfois dans les cellules CD4+ mémoires.
-ex: le virus de l'herpès simplex (buccale) s'installe dans les ganglions
tri-jumeaux (ganglions nerveux) et peuvent rester toute la vie de l'hôte
infecté dans ces ganglions.
La latence correspond souvent (mais pas toujours) à une non-expression
du génome virale (et donc à une non-prolifération virale):
malgrè les anticorps et les LT8 dirigés
contre le virus, le virus reste présent car il ne produit pas d'antigènes
susceptibles d'être reconnus par le système immunitaire.
La seule façon de lutter contre ces virus en latence serait l'utilisation
de sondes d'oligonucléotides antisens qui réduiraient les gènes
viraux au silence
ou d'utiliser une nucléase spécifique qui couperait le(s) gène(s)
viral(aux).Ces traitements sont pour l'instant à l'étude notamment
en ce qui concerne les oligonucléotides antisens.
|