História
Em 1948,
J.A.Nollet descreveu uma experiência em que colocou
espírito de vinho num cilindro, fechou a boca do mesmo
com uma bexiga animal e mergulhou-o em água pura. A
bexiga inchou consideravelmente, algumas vezes chegando a
romper. A membrana animal era semipermeável, a água
pôde atravessá-la, mas o álcool, não.
O aumento de pressão no tubo,
determinado pela difusão da água para a solução é
chamado de pressão osmótica.
O primeiro estudo quantitativo
detalhado da pressão osmótica acha-se numa série de
pesquisas de W. Pfeffer, publicada em 1887.
Definição
Membranas semipermeáveis:
são membranas existentes na natureza que tem a
capacidadede de deixar passar somente líquido (a
água), ou solvente, mas não deixar passar sais
dissolvidos na solução. Na verdade o que se verifica é
uma propriedade seletiva, isto é, o solvente água passa
de um lado para o outro da membrana com muito mais
facilidade do que os solutos (sais ) existentes.
As paredes das células
dos seres vivos são membranas semipermeáveis naturais,
regulando a passagem de sais e nutrientes para dentro da
célula ou para fora dela.
Os cientistas descobriram
que existem membranas sintéticas que exibem a mesmas
propriedades. Talvez a mais comum delas seja o acetato de
celulose.
Osmose:
definida como a passagem espontânea, seja do solvente
puro para a solução, seja de uma solução diluída
para uma solução concentrada, quando as duas fases
líquidas estão separadas por uma menbrana
semipermeável.
A osmose é devida à
diferença de potencial químico dos dois lados da
membrana. O tipo de membrana não importa, requer-se
apenas que seja permeável somente ao solvente. Também
não apresenta importância a natureza do soluto, basta
que o soluto contenha uma substância que não atravessa
a membrana.
Pressão osmótica:
é a pressão que deve ser aplicada à solução para
impedir a passagem do solvente através da membrana
semipermeável.

Equilíbrio envolvido
entre o solvente puro A, numa pressão p, numa face da
membrana semipermeável e o componente A da solução, na
outra face da membrana, sob a pressão
p + 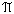 . .
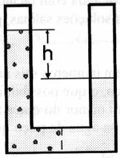
Quando duas soluções,
com diferentes concentrações são separada em um mesmo
recipiente por uma membrana semipermeável, ocorre
espontaneamente a passagem da solução de maior
concentração no sentido da solução menos diluída,
até que ocorra o equilíbrio. O fluxo ocorre
porque a solução menos diluída encontra-se em um
estado de maior energia. Neste ponto de equilíbrio, a
coluna de solução menos concentrada estará
relativamente, abaixo da coluna do lado da solução mais
diluída. A esta diferença de altura entre as colunas
das soluções denomina-se de pressão osmótica.
Difusão:
é o processo pelo qual moléculas ou íons movem-se
espontaneamente de regiões de baixa concentração para
regiões de elevada concentração. As moléculas
movem-se naturalmente e colidem umas com as outras
constantemente. Essas moléculas estão tentando atingir
um estado de equilíbrio, pemanecendo na forma de uma
distribuição uniforme.
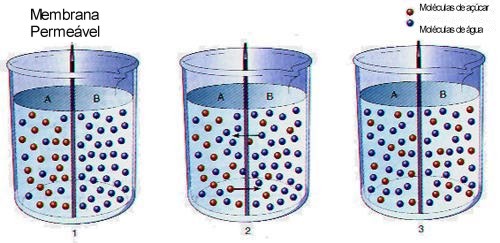
O frasco (1) está
separado em dois compartimentos por uma membrana
semipermeável, que é permeável a água e não ao
açúcar. No compartimento A contém ambas as moléculas,
enquanto que no compartimento B contém somente
moléculas de açúcar. No frasco (2) com o movimento das
moléculas, as moléculas de açúcar tendem a se
difundir do compartimento A para o compartimento B e
moléculas de água tendem a se difundir do compartimento
B para o compartimento A. Já no frasco (3) o equilíbrio
foi alcançado.
Fator de van't Hoff
A análise
termodinâmica da osmose baseia-se na igualdade do
potencial químico do solvente nos dois lados da membrana
semipermeável, uma vez tenha atingido o equilíbrio.
Esta igualdade leva à equação de van't Hoff, para a
pressão osmótica de soluões diluídas:
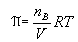
Essa
equação é identica a equação da lei dos gases
ideais, onde 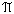 representa a pressão do gás P. representa a pressão do gás P.
A equação de van't Hoff pode ser
utilizar para encontrar os pesos moleculares de solutos
dissolvidos, da mesma maneira que a lei dos gases ideais
é utilizada para descobrir os dos gases. Esse método é
raramente utilizado, exceto em trabalho com polímeros de
cadeia comprida, o motivo é a grande dificuldade de
obter dados precisos das pressões osmóticas de
soluções diluídas.
 Osmometro Osmometro
No
equilíbrio, em cada fase da membrana, a passagem do
solvente A para a solução provocou a elevação de uma
coluna que proporciona pressão hidrostática igual à
pressão osmótica.
Propriedades
Coligativas
Elevação
Ebulioscópica | Abaixamento
Crioscópico | Pressão Osmótica |Aplicações
Consulte
a página  para saber o que há de novo em
cada seção. para saber o que há de novo em
cada seção.

Home
Educação | Eletrônica | Indústria e Comércio | Informática
Internet | Química | Terapia Alternativa
Equipe Much Better
|