2. VNITŘNÍ ENERGIE, PRÁCE A TEPLO
Vnitřní energie tělesa je rovna součtu celkové kinetické energie neuspořádaně se pohybujících částic tělesa (molekul, atomů, iontů) a celkové potenciální energie vzájemné polohy těchto částic. Vnitřní energie tělesa se může měnit konáním práce nebo tepelnou výměnou.
Při konání práce se mění kinetická nebo potencoiální energie tělesa na jeho vnitřní energii a naopak. Součet kinetické, potenciální a vnitřní energie zůstává při dějích probíhajících v izolované soustavě těles konstantní. Při tepelné výměně odevzdávají částice teplejšího tělesa část své energie částicím tělesa chladnějšího. Tepelná výměna se může uskutečnit také prostřednictvím tepelného záření.
Teplo Q je určeno energií, kterou při tepelné výměně teplejší těleso odevzdá tělesu chladnějšímu.
Tepelnou kapacitu tělesa C definujeme vztahem
C = Q.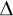 t -1 t -1,
kde Q je teplo, které přijme těleso, když se jeho teplota zvýší o 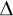 t. Toto teplo můžeme vyjádřit pomocí vztahu t. Toto teplo můžeme vyjádřit pomocí vztahu
Q = cm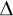 t t.
Veličina c se nazývá měrná tepelná kapacita; její jednotkou je J.kg -1.K -1.
Kalorimetrickou rovnici vyjadřujeme vztahem
c1m1(t1 - t) = c2m2(t = t2),
kde c1, m1 a t1 jsou postupně měrná tepelná kapacita, hmotnost a počáteční teplota teplejšího tělesa; c2, m2 at2 jsou analogické veličiny charakterizující studenější těleso, t je výsledná teplota po dosažení rovnovážného stavu.
Prvnní termodynamický zákon říká, že přírustek vnitřní energie soustavy 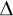 U se rovná součtu práce W vykonané okolními tělesy působícími na soustavu silami a tepla Q odevzdaného okolními tělesy soustavě, tedy U se rovná součtu práce W vykonané okolními tělesy působícími na soustavu silami a tepla Q odevzdaného okolními tělesy soustavě, tedy
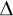 U = W + Q U = W + Qnebo
Q = 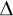 U + W´ U + W´,
kde W´ je práce, kterou vykoná soustava.
|



