11. ELEKTRYCKÝ PROUD V ELEKTROLYTECH
Kapaliny, které vedou elektrický proud, se nazývají elektrilty. Vodivost elektrolytů podmiňují ionty Vložíme-li do elektrolytu dvě elektrody připojené ke zdroji stejnosměrného napětí, dojde k uspořádanému pohybu iontů (záporných k anodě, kladných ke katodě) - vznikne elektrický proud.
Děj, při kterém průchodem elektrického proudu elektrolytem nastávají látkové změny, se nazývá elektrolýza. Pro elektrolýzu platí Faradayovy zákony.
1. Faradayův zákon: Hmotnosti látek vyloučených na elektrodách jsou přímo úměrné celkovému elektrickému náboji, kterýj přenesly ionty při elektrolýze
m = AQ = AI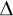 t t.
Konstanta A se nazývá elektrochemický ekvivalent látky
A = F -1.Mm. -1 -1.
hodnoty A jsou pro některé látky uvedené v MFYChT; Faradayova konstanta F  9,652.104.mol -1, Mmje molární hmotnost a 9,652.104.mol -1, Mmje molární hmotnost a  přirozený násobek elementárního náboje přirozený násobek elementárního náboje
2.Faradayův zákon: Hmotnosti různých prvků (nebo radikálů) vyloučených při elektrolýze týmž nábojem jsou chemicky ekvivalentní, přičemž
m ~ Mm. -1 -1
Hmotnost mvyloučené látky určíme ze společného vyjádření obou Faradayových zákonů
|



