
วิธีการเตรียมอาหารเลี้ยงเชื้อ
สำหรับคัดเลือกยีสต์ที่สามารถผลิตเอ็นไซม์
lipase
โดยอาหารเลี้ยงเชื้อมี 2 ชั้น
มีวิธีการเตรียมดังนี้
|
วิธีการเตรียม Oil emulsion Double Layers agar plate (ODL medium)ชั้นล่าง
ชั่ง Peptone 1.0 g ,Yeast extract 0.6 g, , Ammonium nitrate 3.0
g ละลายในน้ำกลั่น 800 ml ปรับ pH เป็น 6.8
โดยใช้ phosphoric acid และปรับปริมาตรเป็น
1000 ml เติม Agar 15 g
นำไปเข้าไมโครเวฟเพื่อให้ agar
ละลาย ก่อนนำไปautoclave ที่ อุณหภูมิ 121
องศาเซลเซียส ความดัน 15
ปอนด์/ตารางนิ้ว เป็นเวลา 15 นาที
เติม Chloramphenicol (50 mg/ml) 1 ml
เทอาหารเลี้ยงเชื้อลงบนจานเลี้ยงเชื้อประมาณ
15 ml แล้วรอให้วุ้นแข็ง
วิธีการเตรียม Oil emulsion Double
layers agar plate (ODL medium)ชั้นบน
ชั่ง Peptone 1.0 g ,Yeast extract 0.6 g ,Ammonium nitrate 3.0 g
ละลายในน้ำกลั่น 800 ml ปรับ pH 6.8
โดยใช้ phosphoric acid
และปรับปริมาตรของอาหารเลี้ยงเชื้อเป็น
1000 ml เติม Agar 15 g
นำไปเข้าไมโครเวฟเพื่อให้ agar
ละลาย ก่อน นำไปautoclave ที่ อุณหภูมิ 121
องศาเซลเซียส เป็นเวลา 15 นาที เติม
Chloramphenicol (50 mg/ml) 1 ml เติม Olive oil emulsion ที่อุ่น ๆ
ปริมาตร 30 ml ผสมให้เข้ากัน
เทอาหารเลี้ยงเชื้อที่เตรียมได้
ลงบนอาหารเลี้ยงเชื้อชั้นล่างจากข้อ
3 ประมาณ 5 ml รอให้วุ้นแข็ง
|
 
 แสดงผล olive และ
olive oil emulsion ที่เตรียมได้ แสดงผล olive และ
olive oil emulsion ที่เตรียมได้
|
เตรียม Olive oil emulsion
ละลาย
tween-80 1 กรัมลงในน้ำกลั่น 500 ml ที่อุ่น
ๆ อุณหภูมิประมาณ 45-50 องศา เซลเซียส
เพื่อให้ tween 80 ละลายดีขึ้น เติม Olive oil
100 ml
นำสารผสมที่ได้ไปปั่นด้วยเครื่อง
blender เป็นเวลา 1 นาที จากนั้นจะได้ olive
oil emulsion
ที่มีลักษณะขาวขุ่นเหมือนนมสด
นำไป autoclave ที่ อุณหภูมิ 121
องศาเซลเซียส เป็นเวลา 15 นาที |

การเก็บตัวอย่างเกสรดอกไม้
เตรียมสารละลาย Normal saline 0.85 %
แบ่งใส่หลอดทดลองหลอดละ 3 ml โดยใช้
serological pipette นำไป autoclave ที่ อุณหภูมิ 121
องศาเซลเซียส ความดัน 15
ปอนด์/ตารางนิ้ว เป็นเวลา 15 นาที
เก็บตัวอย่างดอกไม้จากแหล่งต่าง
ๆ มาตัดเฉพาะส่วนเกสรดอกไม้
ใส่ใน Normal saline ที่
ผ่านการฆ่าเชื้อแล้ว นำไป Mix
ด้วยเครื่อง vortex
เพื่อให้มีการกระจายตัวของเชื้ออยู่ในสารละลาย
Normal saline |
 
 ตัวอย่างดอกไม้จากแหล่งต่าง
ๆ ตัวอย่างดอกไม้จากแหล่งต่าง
ๆ
|
วิธีทำการคัดเลือก
นำสารละลาย Normal saline ที่ได้ มา 1.5
ml ใส่ใน eppendrof
นำไปปั่นเหวี่ยงให้ตกตะกอนโดยใช้เครื่อง
microcentrifuge ความเร็ว 12,000 รอบต่อนาที
เป็นเวลา 10 นาที
ดูดสารละลายส่วนใสชั้นบนออก 1.3 ml
ทำซ้ำ จนกระทั่งสารละลาย normal saline
ที่ผสมเกสรดอกไม้ที่เตรียมได้หมด
หลังจากดูดส่วนใสชั้นบนออก
นำส่วนที่เหลือผสมให้เข้ากันดูดมา
100 m l ด้วย micro pipette
หยดลงบนอาหารเลี้ยงเชื้อ ODL
ที่เตรียมได้ แล้วทำการ spread plate
เมื่อมีเชื้อยีสต์เกิดขึ้น
pick colony ยีสต์ออกจาก primary plate
เพื่อไม่ให้ contaminate จากรา
ด้วยวิธีการต่อไปนี้
จุ่มปากคีบลงใน Alc 95 %
และลนด้วยไฟเพื่อฆ่าเชื้อ
ใช้ปากคีบหยิบไม้จิ้มฟันที่ผ่านการฆ่าเชื้อแล้ว
ใช้ไม้จิ้มฟันแตะโคโลนียีสต์ที่ต้องการ
นำไม้จิ้มฟันที่แตะโคโลนียีสต์แล้ว
มา spot บนอาหารเลี้ยงเชื้อ OLD mediumที่
เตรียมไว้
โดยแตะเชื้อให้ห่างกันประมาณ 1
เซนติเมตร สังเกต clear zone
ที่เกิดขึ้น รอบ ๆ โคโลนีของยีสต์
นำเชื้อที่เกิด clear zone
ไปแยกให้บริสุทธิ์ โดยการ streak plate
นำเชื้อที่บริสุทธิ์แล้วแยกเก็บเป็น
stock ในอาหารเลี้ยงเชื้อสูตร yeast extract
peptone dextrose (YPD)
วิธีการเตรียมอาหารสูตร YPD
โดย ชั่ง yeast extract 5 กรัม peptone 20 กรัม dextrose 20
กรัม ละลายในน้ำกลั่น 800 ml
ปรับปริมาตรเป็น 1000 mlใส่ agar 15 กรัม
นำไปเข้าไมโครเวฟให้ agar ละลาย
นำไปautoclave ที่ อุณหภูมิ 121
องศาเซลเซียส เป็นเวลา 15 นาที
เทอาหารเลี้ยงเชื้อลงบนจานเลี้ยงเชื้อประมาณ
20 ml แล้วรอให้วุ้นแข็ง เชื้อที่ streak
plate
แล้วนำไปเพาะเลี้ยงที่อุณหภูมิ 30
องศาเซลเซียส plate
ที่มีเชื้อขึ้นแล้วเก็บเป็น stock
โดยเก็บในตู้เย็นที่อุณหภูมิ 4
องศาเซลเซียส
ก่อนเก็บใช้พาราฟิล์มพันรอบ plate
เพื่อป้องกันการ contaminate จากหยดน้ำ

การจำแนกสายพันธุ์เชื้อยีสต์
| นำเชื้อที่สร้าง
clear zone และเชื้อ control (Saccharomyces cerevisiae)
มาถ่ายเชื้อลงในอาหารเลี้ยงเชื้อ
(YPD) โดยการ streak plate |
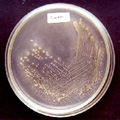
 เชื้อยีสต์ที่
streak บน plate เชื้อยีสต์ที่
streak บน plate
|
นำเชื้อยีสต์ไปเพาะเลี้ยงที่
อุณหภูมิ 30 องศาเซลเซียสเป็น 1 วัน
นำเชื้อยีสต์ที่แยกได้เป็นโคโลนีเดี่ยว
ๆ มาศึกษา เพื่อจำแนกชนิด
โดยวิธีการต่อไปนี้ |
ตรวจสอบ ลักษณะการ budding
มีขั้นตอนดังนี้

 ูลักษณะการ budding ูลักษณะการ budding
|
ชั่ง malt extract broth 1.5
กรัมละลายในน้ำกลั่น 80 ml
ปรับปริมาตรเป็น100 ml
แบ่งใส่หลอดทดลองฝาเกลียว
หลอดละ 3 ml โดยใช้ serological pipette นำไป autoclave
ที่อุณหภูมิ 121 องศาเซลเซียส
ความดัน 15 ปอนด์/ตารางนิ้ว เวลา 15
นาที
ใช้ลูปเขี่ยเชื้อที่ต้องการทดสอบ
โดยเลือกโคโลนีเดี่ยว
รวมทั้งเชื้อ control
ใส่ลงในอาหารเลี้ยงเชื้อที่เตรียมได้
นำไปเพาะเลี้ยงที่อุณหภูมิ 30
องศาเซลเซียส เป็นเวลา 1 วัน
นำเชื้อที่เลี้ยงในหลอดทดลองมาตรวจดูลักษณะการ
budding โดยใช้ลูปเขี่ยเชื้อประมาณ 1
ลูป แตะลงบนกระจกสไลด์ ปิดด้วย
coverslip แล้วไปส่องใต้กล้อง
จุลทรรศน์ กำลังขยาย 400 เท่า
บันทึกผลการทดลอง
ตรวจดูลักษณะการ budding ทุกวันจนครบ 3
วัน |
ดูผล

ตรวจสอบลักษณะการสร้าง spore
|
ชั่ง Sodium citrate dihydrate (C6H5Na3O7
2H2O) 0.193 กรัม ละลายในน้ำกลั่น 80 ml
ปรับปริมาตรเป็น 100 ml ปรับ pH เป็น 6.8
ชั่ง Agar 1.5 กรัม
ใส่ไปในสารละลายที่ปรับ pH แล้ว
นำไปเข้าไมโครเวฟ เพื่อให้ Agar
ละลาย แบ่งใส่ขวดแบนขนาด 80 ml ขวดละ
30 ml นำไปautoclave ที่ อุณหภูมิ 121
องศาเซลเซียส ความดัน 15
ปอนด์/ตารางนิ้ว เป็นเวลา 15 นาที
นำอาหารเลี้ยงเชื้อในขวดแบนมาเอียงเพื่อทำ
slant นำเชื้อยีสต์ที่สร้าง clear zone
และเชื้อ control
ที่ได้เป็นโคโลนีเดี่ยว ๆ มา streak
ลงบนอาหารเลี้ยงเชื้อที่ทำ slant
ไว้
ตรวจผลการสร้างสปอร์เมื่อเลี้ยงไว้บน
slant เป็น 1, 2, 3, 4, 5, และ 6
สัปดาห์ตามลำดับ |

 ลักษณะสปอร์
ของเชื้อยีสต์ S. cerevisiae ลักษณะสปอร์
ของเชื้อยีสต์ S. cerevisiae
|
ดูผล
ตรวจสอบลักษณะการสร้าง mycelium
เตรียม
corn meal agar 17 กรัม ละลายในน้ำ 800 ml
ปรับปริมาตรเป็น 1000 ml นำไปautoclave ที่
อุณหภูมิ 121 องศาเซลเซียส ความดัน 15
ปอนด์/ตารางนิ้ว เป็นเวลา 15 นาที
เทอาหารเลี้ยงเชื้อลงบนจานเลี้ยงเชื้อประมาณ
20 ml แล้วรอให้วุ้นแข็ง
เขี่ยเชื้อที่สร้าง clear zone และเชื้อ
control มา 1
โคโลนีวางลูปเขี่ยเชื้อประมาณ 30
องศา
แทงผ่านเนื้อวุ้นแล้วลากเป็นเส้นตรง
ปิดบริเวณรอย streak ให้ทั่วด้วย coverslips
เพาะเลี้ยงไว้ที่อุณหภูมิ 30
องศาเซลเซียส ตรวจดู mycelium
โดยใช้กล้องจุลทรรศน์ กำลังขยาย
400 เท่าเมื่อเลี้ยงเป็นเวลา 3, 5, และ
7 วัน บันทึกผลการทดลอง

ตรวจสอบการ fermentation

 ผลการ ferment
น้ำตาล สังเกตสีและการสร้างก๊าซ ผลการ ferment
น้ำตาล สังเกตสีและการสร้างก๊าซ
|
เตรียม stock indicator โดยชั่ง bromothymol blue 0.05
กรัม ละลายในน้ำกลั่น 75 ml เตรียม basal
medium โดยชั่ง yeast extract 0.225 กรัม และ peptone 0.375
กรัม ละลายในน้ำกลั่น 50 ml เติมสาร
indicator จาก stock 2 ml ลงใน basal medium
แล้วละลายให้เข้ากัน ปรับ pH เป็น 7
แบ่งใส่หลอดทดลองฝาเกลียวขนาด 150? 12 mm หลอดละ 2 ml ใส่หลอดดัก
ก๊าซลงไปทุกหลอด นำไปautoclave ที่
อุณหภูมิ 121 องศาเซลเซียส ความดัน 15
ปอนด์/ตารางนิ้ว เป็นเวลา 15 นาที
เตรียมสารละลายน้ำตาล galactose, glucose, lactose,
maltose และsucrose ชนิดละ 6 %
กรองสารละลายผ่าน filter sterile
โดยใช้กระดาษกรองชนิด nitrocellulose ขนาด
0.45 m แต่ละหลอดทดลอง
ใส่สารละลายน้ำตาลปริมาตร 1 ml
เขี่ยเชื้อรวมทั้งเชื้อ control ลงบน
media ที่เตรียมได้ จ
สังเกตการเปลี่ยนแปลง
สีของอาหารเลี้ยงเชื้อและการสร้างก๊าซ
บันทึกผลการ ทดลองจนครบ 6 สัปดาห์ |
ดูผล
ตรวจสอบการใช้ไนเตรต

 ผลการทดสอบการใช้
ผลการทดสอบการใช้
้ไนเตรต
|
เตรียมอาหารเลี้ยงเชื้อ
เตรียม YCB 1.17 กรัมและ NaNO3 0.5กรัมละลายในน้ำ
3A ปริมาตร 100 ml เตรียม YCB 1.17 กรัม
ละลายในน้ำ 3A ปริมาตร 100 ml เตรียม YPD
Broth ปริมาตร 100 ml แบ่งอาหารแต่ละชนิด
ใส่หลอดทดลอง หลอดละ 5 ml เตรียมน้ำ
3A แบ่งใส่หลอดทดลอง หลอดละ 3
mlนำไปautoclave ที่อุณหภูมิ 121
องศาเซลเซียส ความดัน 15
ปอนด์/ตารางนิ้ว เป็นเวลา 15 นาที
ใช้ปากกาสีดำ ขนาด 0.7 mm
ขีดเป็นเส้นตรง ความยาว 2
เซนติเมตร บนกระดาษสีขาว
เขี่ยเชื้อที่สร้าง clear zone และเชื้อ
control ลงในน้ำ 3A
จนมองเห็นเส้นสีดำจางๆ ชนิดละ 1
หลอด ดูดเชื้อที่ได้
มาลงในอาหารเลี้ยงเชื้อที่มี NaNO3
ไม่มี NaNO3 และ YPD ชนิดละ100 m l
บันทึกผลการทดลองจนครบ 3 วัน |
ดูผล

ตรวจสอบการใช้ inositol
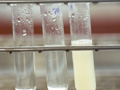
 ผลการทดสอบการใช้ inositol
ผลการทดสอบการใช้ inositol
|
ชั่ง YNB 0.67 กรัม และ
inositol 0.5 กรัม ละลายในน้ำ 3A ปริมาตร 100 ml
เตรียม YNB 0.67 กรัม ละลายในน้ำ 3A
ปริมาตร 100 ml เตรียม YNB 0.67 กรัม และ glucose 1
กรัม ปริมาตร 100 ml
แบ่งอาหารแต่ละชนิด
ใส่หลอดทดลอง หลอดละ 5 ml เตรียมน้ำ
3A แบ่งใส่หลอดทดลอง หลอดละ 3 ml
นำไปautoclave ที่อุณหภูมิ 121
องศาเซลเซียส ความดัน 15
ปอนด์/ตารางนิ้ว เป็นเวลา 15 นาที
ใช้ปากกาสีดำ ขนาด 0.7 mm
ขีดเป็นเส้นตรง ความยาว 2
เซนติเมตร บนกระดาษสีขาว
เขี่ยเชื้อที่สร้าง clear zone และ
เชื้อ control ลงในน้ำ 3A
จนมองเห็นเส้นสีดำจาง ๆ ชนิดละ 1
หลอด ดูดเชื้อที่ได้จากข้อ 3.5.3
มาลงในอาหารเลี้ยงเชื้อที่มี inositol
,ไม่มี inositol และ มี glucose 1 %
ชนิดละ100 m l บันทึกผลการทดลองจนครบ
3 วัน |
ดูผล

  
|